下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )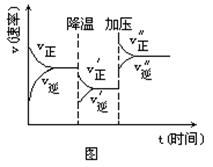
A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应. D.A、B、C、D均为气体
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后对铁制品失去保护作用 |
用电解法提取氯化铜废液中的铜,方案正确的是( )
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化钠溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
如图是模拟电化学反应装置图。下列说法正确的是( )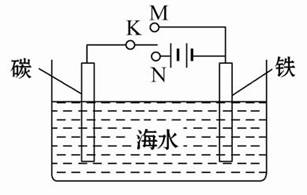
| A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+ |
| B.开关K置于N处,可以减缓铁的腐蚀 |
| C.开关K置于M处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑ |
| D.开关K置于M处,电子从碳棒经开关K流向铁棒 |
下列说法正确的是( )
| A.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
| D.电解食盐水一段时间后,可通入一定量的HCl气体来恢复原溶液 |
如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )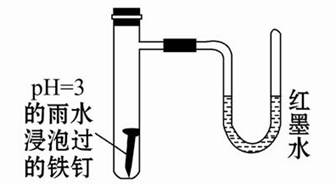
| A.开始时发生的是析氢腐蚀 |
| B.一段时间后发生的是吸氧腐蚀 |
| C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+ |
| D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2 |