下列叙述错误的是 ( )
(1)所有的碱性氧化物都是金属氧化物
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
| A.全部 | B.(1)(2)(3)(4) |
| C.(1)(2)(3)(5) | D.(2)(3)(4)(5) |
将4 mol A气体和2 mol B气体在2L的密闭容器中混合并在一定条件下发生反应2A(g)+B(g)  2C(g),2 s时测得C的浓度为0.6mol·L-1。下列说法正确的是
2C(g),2 s时测得C的浓度为0.6mol·L-1。下列说法正确的是
| A.用物质A表示的平均反应速率为0.3mol/(L·s) |
| B.用物质B表示的平均反应速率为0.6mol/(L·s); |
| C.2 s时物质A的转化率为70% |
| D.2 s时物质B的浓度为0.7mol·L-1 |
下列有关电池的说法不正确的是
| A.手机上用的锂离子电池属于二次电池 |
| B.锌锰干电池中,锌电极是负极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.铜锌原电池电子沿外电路从铜电极流向锌电极 |
下列表示物质结构的化学用语或模型图正确的是:
| A.HClO的结构式:H-O-Cl | B.H2O2的电子式: |
C.CO2的比例模型: |
D.14C的原子结构示意图: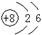 |
为了更好的解决能源问题,人们一方面研究如何提高燃料的燃烧效率,另一方面寻找新能源。以下做法不能提高燃料效率的是
| A.将煤转化成煤气 | B.液体燃料呈雾状喷出 |
| C.通入大大过量的空气 | D.将煤粉粉碎 |
对于敞口容器中的化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ,下列叙述 不正确的是
不正确的是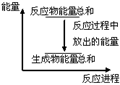

A.锌不能用来表示该反应的速率,其它反应物和生成物都能用来表示该反应的速率(molL-1S-1) |
B.反应过程中能量关系可用右图表示 |
C.若将该反应设计成原电池,锌为负极 |
D.若将其设计为原电池,当有32.5g锌溶解时, 正极放出标况下11.2L气体 正极放出标况下11.2L气体 |