按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。
根据下列化合物:①NaOH,②H2SO4,③CH3COOH, ④NaCl, ⑤CH3COONa, ⑥NH4Cl,⑦CH3COONH4,⑧NH4HSO4, ⑨NH3•H2O, 请回答下列问题:
(1)NH4Cl溶液中离子浓度大小顺序为;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)=;
(3)已知水存在如下平衡:H2O+ H2O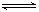 H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6 mol•L-1] | D.向水中加入NH4Cl固体 |
(4)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则 mn (填 “<”、“>”或“=”)。
(5)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)________。
(6) 物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是(填序号)。
浓度由大到小的顺序是(填序号)。
(7)已知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=______。
(10分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: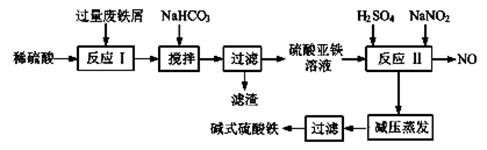
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
A1(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式。
②加入少量NaHCO3的目的是调节溶液的pH,应控制pH的范围为。
③在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,该水解反应的离子方程式为。
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g) 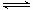 CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g) 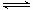 CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g) 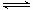 CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为__________ _。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是
__________(填字母代号)。
A高温高压 B加入催化剂 C减少CO2的浓度
D增加CO的浓度 E.分离出二甲醚
(3)已知反应②2CH3OH(g)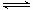 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c / mol·L-1 |
0.44 |
0.60 |
0.60 |
此时,v (正) _____ v (逆) (填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是_____。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO、Ba2+、SO。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 |
试验内容 |
试验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27g 第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验判断混合物中一定存在的阴离子是,一定存在的阳离子是,一定不存在的离子是________,无法确定的离子是。
(2)写出实验2中发生反应的离子方程式。
为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如下: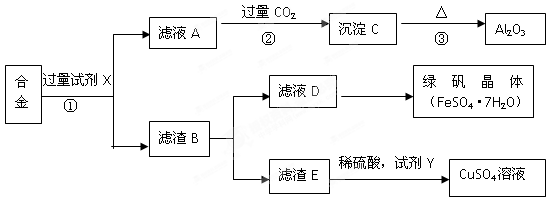
(1)写出反应①的离子方程式。
(2)步骤②中通入过量的CO2时生成沉淀的化学方程式为。
(3)检验滤液D是否含有Fe3+的最佳试剂为 (填序号)
A、KMnO4 B、NaOH C、氯水 D、KSCN
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤: 、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)
A.蒸发皿 B.石棉网 C.烧杯 D.玻璃棒
(5)试剂Y应该是一种 (填“氧化剂”或“还原剂”),它不可能是
A、H2O2 B、铁单质 C、O2