(每空1分,共8分)实验室需要配制0.1 mol/L CuSO4溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、_______ _、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4固体8.0g | B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g | D.需要CuSO4固体7.7 g |
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________ 。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________。
(6)定容,摇匀。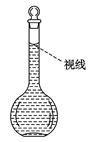
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
某同学利用下图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,,其操作可分解为如下几步:
| A.用标准溶液润洗滴定管2~3次 |
| B.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.调节液面至0或0以下刻度,记下读数 |
E. 移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度读数。
G.把锥形瓶里的溶液倒掉,用蒸馏水把锥形瓶洗涤干净。按上述操作重复一次,并记下滴定前后液面刻度的读数。
就此实验完成填空: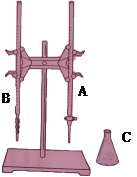
(1)上图所示是常用的仪器,(填实验名称)。图中A是(填仪器名称)
(2)判断到达滴定终点的实验现象是:_______
(3)上述E步骤操作之前,先用蒸馏水润洗锥形瓶,则对滴定结果的影响是
(填“偏高”、 “ 偏低”或“无影响”)。
(4)重复做该实验4次。所得实验数据如下表:
| 实验次数 |
c(KOH)/mol·L-1 |
B中起点刻度 |
B中终点刻度 |
V(HCl)/ml |
| 1 |
0.1000 |
0 |
24.95 |
25.00 |
| 2 |
0.1000 |
0 |
24.96 |
25.00 |
| 3 |
0.1000 |
0 |
24.50 |
25.00 |
| 4 |
0.1000 |
0 |
24.94 |
25.00 |
请你确定盐酸的物质的量浓度为mol/L
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为而后又发生反应的离子方程式为
在(Ⅱ)中煮沸溶液的目的是
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是。
(2)按该同学的设计,第(I)步实验装置如下: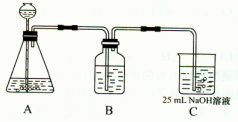
①装置A使用的试剂是(固体)和;
②装置B使用的试剂最好是(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有。
(1)控制变量是科学研究中的重要研究方法,其基本思路是,在实验研究中人为只改变一个因素(调节变量),其他因素保持相同,观察测定因调节变量改变而改变的因素(因变量),从而分析得到研究结论。中学化学中应用控制变量的方法研究问题的例子很多。请分析或设计:
①在研究浓度对化学反应速率的影响时,教材安排了利用Na2S2O3与H2SO4反应的一组对照实验(Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O)
| 烧杯 编号 |
加3% Na2S2O3溶液体积(mL) |
加H2O体积(mL) |
加(体积之比为1∶2)H2SO4溶液体积(mL) |
所需时间(s) |
| 1 |
5 |
5 |
2 |
|
| 2 |
7 |
3 |
2 |
|
| 3 |
10 |
0 |
2 |
在三个烧杯(底部有黑色“十”字标记)内分别加入表中所示体积的三种液体,搅拌并开始计时,到出现浑浊使烧杯底部“十”字看不见时停止计时。比较所需时间,得出浓度对化学反应速率影响的结论。实验中,温度和反应体系中硫酸浓度是保持相同的因素,调节变量是____________________,因变量是______________。
②运用控制变量原理设计实验,利用纯碱溶液探究温度对盐的水解的影响,简述实验方法:________________________________________________________________________。
(2)373 K时,H2PO3-与OH-发生如下反应:
H2PO3-+OH-HPO32-+H2O
反应结果如表所示:
| H2PO3-起始浓度(mol/L) |
0.10 |
0.50 |
0.50 |
| OH-起始浓度(mol/L) |
1.00 |
1.00 |
4.00 |
| 反应速率[mol/(L·s)] |
3.2×10-5 |
1.60×10-4 |
2.56×10-3 |
如果用v=kcm(H2PO3-)·cn(OH-)表示反应速率(k为与浓度无关的常数)
①k=________,m=________,n=________。
②若c(H2PO3-)的起始浓度为0.20 mol/L,c(OH-)的起始浓度为1.50 mol/L,则反应速率v=________。
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定.
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g.
(2)从下图中选择称量NaOH固体所需要的仪器(填序号)________.
Ⅱ.测定中和热的实验装置如图所示
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ____________________________________________.
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如表.
①请填写表中的空白:
| 温度 实验 次数 |
起始温度t1/℃ |
终止温度t2/℃ |
平均温度差(t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
| 2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃).则中和热ΔH=________(取小数点后一位).
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________.
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_____________________________________________________;
(2)实验过程中,装置B、C中发生的现象分别是__________________、____________________,这些现象分别说明SO2具有的性质是________和________;装置B中发生反应的离子方程式为_______________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象__________________________________________________________;
(4)尾气可采用________溶液吸收。