过渡金属催化的新型碳碳偶联反应是近年来有机合成的研究热点之一,如: 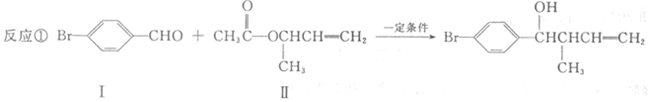
(1)化合物I的分子式为 。
(2)化合物Ⅱ与Br2加成的产物的结构简式为 。
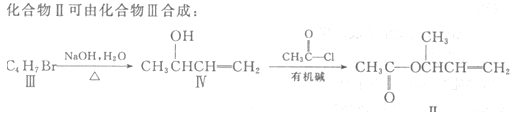
(3)化合物Ⅲ的结构简式为 。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为 因此,在碱性条件下,由Ⅳ与CH3CO--Cl反应合成Ⅱ,其反应类型为 。
(5)Ⅳ的一种同分异构体V能发生银镜反应。V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种)。
卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应。其实质是带负电的原子团(如OH-等阴离子)取代了卤代烃中的卤原子。例如CH3CH2CH2—Br+OH-→CH3CH2CH2—OH+Br-。
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应______________________________________________________。
(2)碘甲烷跟CH3COONa反应_________________________________________________。
(3)由碘甲烷,无水乙醇和金属钠合成甲乙醚(CH3OCH2CH3)____________________。
A、B、C、D四种有机物的化学式均为C3H6O2,试根据下列性质确定它们的结构式:
(1)A既能跟金属钠起反应又能跟Na2CO3溶液起反应:______________________________。
(2)B既能发生银镜反应又能发生水解反应:__________________________________。
(3)C只能发生水解反应生成两种有机物:__________________________________。
(4)D既能发生银镜反应又能发生酯化反应:__________________________________。
(6分)天然蛋白质水解产物中含化合物A,A由C、H、O、N四种元素组成,A能与NaOH反应,也能与盐酸反应,在一定条件下,两分子的A发生反应生成B和一个水分子,B的相对分子质量为312。此化合物遇浓硝酸显黄色,由上推断,A的结构简式为______________,
B的结构简式为______________________。
使用某些有机物材料给环境造成的“白色污染”后果严重。最近研究的一些分解性塑料,有良好的生物适应性和分解性,能自然腐烂分解。如: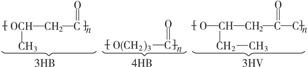
已知3HB的单体叫3-羟基丁酸,则:
(1)4HB的单体名称是_______________,3HV的单体名称是_______________;
(2)两分子4HB的单体脱水时,生成的环酯的结构简式为_______________。
耐纶是一种重要的合成纤维,用它可制取具有光泽、坚牢、耐拉和耐化学腐蚀的人造丝和人造毛。下面是高聚物耐纶分子的一部分。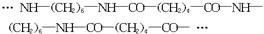
(1)合成耐纶的单体有______________种。
(2)具有碱性的单体的结构简式____________________________。
(3)合成耐纶的反应称为______________反应。