I.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。
已知该反应中H2O2只发生如下过程:H2O2→O2。
(1) 该反应中的还原剂是________。
(2) 该反应中,发生还原反应的过程是________→________。
(3) 写出该反应的化学方程式,并标出电子转移的方向和数目:
_____________________ __ 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
II.高锰酸钾在不同的条件下发生的反应如下:
MnO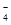 +5e-+8H+===Mn2++4H2O ①
+5e-+8H+===Mn2++4H2O ①
MnO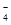 +3e-+2H2O===MnO2↓+4OH- ②
+3e-+2H2O===MnO2↓+4OH- ②
MnO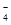 +e-===MnO
+e-===MnO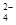 (溶液绿色) ③
(溶液绿色) ③
(1) 从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2) 将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为
__________→___________。
(3) 将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________
a. 氧化性:PbO2>KMnO4
b. 还原性:PbO2>KMnO4
c. 该反应可以用盐酸酸化
(4) 将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):
① ________KMnO4+________K2S+______( )===________K2MnO4+________K2SO4+________S↓+______( )。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为________。
衣康酸
是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件略).
(1)
发生加聚反应的官能团名称是,所得聚合物分子的结构型式是(填"线型"或"体型").
(2)
→
的化学方程式为.
(3)
的同分异构体
是饱和二元羧酸,则
的结构简式为(只写一种).
(4)已知:
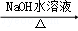 +
,
经五步转变成M的合成反应流程(如图1):
+
,
经五步转变成M的合成反应流程(如图1):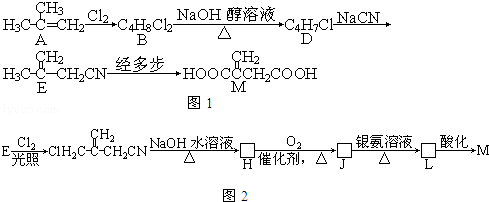
①
→
的化学反应类型为,
→
的化学方程式为.
②
→
的离子方程式为.
③已知:
 +
,
经三步转变成M的合成反应流程为(示例如图2;第二步反应试剂及条件限用
水溶液、加热).
+
,
经三步转变成M的合成反应流程为(示例如图2;第二步反应试剂及条件限用
水溶液、加热).
氯离子插层镁铝水滑石
是一种新型离子交换材料,其在高温下完全分解为
、
、
和水蒸气.现用如图装置进行实验确定其化学式(固定装置略去).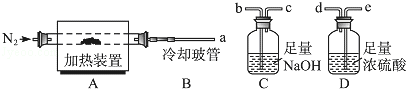
(1)
热分解的化学方程式为.
(2)若只通过测定装置
、
的增重来确定x,则装置的连接顺序为(按气流方向,用接口字母表示),其中
的作用是.装置连接后,首先要进行的操作的名称是.
(3)加热前先通
排尽装置中的空气,称取
、
的初始质量后,再持续通入
的作用是、等.
(4)完全分解后测得C增重3.65
、
增重9.90
,则
=.若取消冷却玻管
后进行实验,测定的
值将(填"偏高"或"偏低").
(5)上述水滑石在空气中放置时易发生反应生成
,该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定
,除测定
的增重外,至少还需测定.
金刚石、
具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素
的单质化合仅能生成两种常见气态化合物,其中一种化合物
为非极性分子.碳元素在周期表中的位置是,
是,
的电子式为.
(2)一定条件下,
还原
可制备金刚石,反应结束冷却至室温后,回收其中的
的实验操作名称为,除去粗产品中少量钠的试剂为.
(3)碳还原
制
,其粗产品中杂质为
和
.现将20.0
粗产品加入到过量的
溶液中充分反应,收集到0.1
氢气,过滤得
固体11.4
,滤液稀释到1
.生成氢气的离子方程式为,硅酸盐的物质的量浓度为.
(4)下列叙述正确的有(填序号).
①
还原
的反应、与
的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③
溶液与
的反应可用于推断
与
的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
[化学﹣有机化学基础]
合成
(一种抗氧化剂)的路线如下:
已知:① (
为烷基);
(
为烷基);
②
和F互为同分异构体,
分子中有三个甲基,
分子中只有一个甲基.
(1)
→B的反应类型为.
经催化加氢生成
(
),
的化学名称是.
(2)
与浓HBr溶液一起共热生成H,H的结构简式为.
(3)实验室中检验
可选择下列试剂中的.
a.盐酸 b.
溶液
c.
溶液 d.浓溴水
(4)
与足量
溶液反应的化学反应方程式为(有机物用结构简式表示).
金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)
是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是.
(3)过滤金属配合物
的中心原子价电子数与配体提供电子总数之和为18,则
.
与
结构相似,
分子内
键与
键个数之比为.
(4)甲醛(
)在
催化作用下加氢可得甲醇(
).甲醇分子内
原子的杂化方式为,甲醇分子内的
键角(填"大于""等于"或"小于")甲醛分子内的
键角.