关于如图所示各装置的叙述中,正确的是( )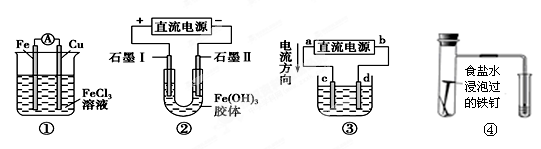
| A.装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2 |
| B.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
| C.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| D.装置④研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-= Fe2+ |
由溴乙烷制取乙二醇,依次发生反应的类型是()
| A.取代、加成、水解 | B.消去、加成、取代 |
| C.水解、消去、加成 | D.消去、水解、取代 |
下列纯净物中既能跟氢气反应,又能跟高锰酸钾溶液反应,但既不能跟溴水发生加成反应,又不能发生加聚反应的是()
| A.裂化汽油 | B.直馏汽油 | C.甲苯 | D.苯 |
下列四种烃的名称所表示的物质,命名正确的是()
| A.2-甲基-2-丁烯 | B.2-乙基丙烷 |
| C.3-甲基-2-丁烯 | D.2,2-二甲基-3-戊炔 |
某有机物C3H6O2的核磁共振氢谱中有两个共振峰,面积比为1︰1,该有机物的结构简式是()
用相对分子质量为43的烷基取代甲苯苯环上的1个氢原子,所得芳香烃产物的数目为()
| A.3 | B.4 | C.5 | D.6 |