某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
| 指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
| 变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂。
(2)右图表示50 mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。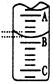
(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为V mL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):
c= mol/L。
下列物质中属于强电解质的是 。
①含有强极性键的HF ②不溶于水的BaSO4、AgCl ③稀H2SO4溶液 ④易溶于水的醋酸 ⑤Na2O、Na2O2、NaCl ⑥水溶液浓度为0.1 mol·L-1,pH=1的HA ⑦NH3的水溶液⑧氯水
书写电离方程式
硫酸氢钠(熔融) ;
亚硫酸 ;
一水合氨 。
已知一定温度和压强下,在容积为1 L的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g) C(g) △H<0。2min达到平衡时,C的物质的量浓度为0.4mol/L。试回答有关问题:
C(g) △H<0。2min达到平衡时,C的物质的量浓度为0.4mol/L。试回答有关问题:
(1)C的反应速率为 。
(2)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(3)A的转化率为 。
(4)若平衡时,保持容器压强不变,充入惰性气体,则平衡_______。
| A.一定向正反应方向移动 |
| B.一定向逆反应方向移动 |
| C.一定不移动 |
| D.不一定移动 |
(5)反应达到平衡时,C的体积分数为_______;
(6)平衡常数K的值为 (用分数表示)。
对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态(填“气”或“非气”)。
(2)增压,平衡不移动,当n=2时,A的状态为________态;(填“气”或“非气”)
当n=3时,A的状态为______态。(填“气”或“非气”)
(3)若A为固体,增大压强,C的组分含量减少,则n____2(填>、=、<)
(4)升温,平衡向右移动,则该反应为________反应(填吸热或放热)。
火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知N2 (g) + 2O2 (g)=2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g)=N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4和NO2反应的热化学方程式为____________________________________________