反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示, 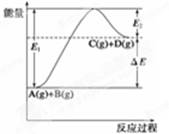
①正反应为放热反应,②反应物总能量低于生成物总能量,③反应物的总键能小于生成物的总键能,④1molA与1molB充分反应后,能量变化为ΔE,⑤加入催化剂后,反应加快,ΔE减小,⑥反应达到平衡时,升高温度,A的转化率增大,⑦升高温度可增大正反应速率,降低逆反应速率,⑧E2是反应C(g)+D(g)  A(g)+B(g) 的活化能,以上有关说法正确的是
A(g)+B(g) 的活化能,以上有关说法正确的是
| A.⑤⑥⑦⑧ | B.①②③④ | C.①③⑤⑦ | D.②⑥⑧ |
某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不与酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是()
| A.Fe2+、Cu2+ | B.Cu2+、H+ | C.Zn2+、Fe2+ | D.Zn2+、H+ |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是()
| A.1mol NH3所含有的原子数为NA |
| B.常温常压下,22.4L氧气所含的原子数为2NA |
| C.常温常压下,48g O2和O3的混合气中含有的氧原子数为3NA |
| D.1mol/L的NaCl溶液中所含Na+为NA |
下列反应的离子方程式中正确的是()
| A.铜片插入硝酸银溶液中: Cu + Ag+ = Cu2+ + Ag |
| B.氢氧化钡溶液与稀硫酸混合:Ba2++ OH-+H++SO42-=BaSO4↓+ H2O |
| C.碳酸钙溶于稀盐酸中: CaCO3+2H+=Ca2++H2O+CO2 |
| D.石灰乳与Na2CO3溶液混合:Ca2++CO32-==CaCO3↓ |
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl—的物质的量浓度相同的是()
| A.200mL0.25mol/LCaCl2溶液 | B.200mL0.25mol/LHCl溶液 |
| C.50mL1mol/LNaCl溶液 | D.100mL0.5mol/LMgCl2溶液 |
对四种无色溶液进行检验,实验结果如下,其中明显错误的是()
| A.K+,Na+,Cl-,NO3- | B.CO32-,OH-,Cl-,K+ |
| C.Cu2+,NO3-,OH-,HCO3- | D.NH4+,H+,Cl-,Al3+ |