某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理正确的是
| 盐酸 |
50 mL |
50 mL |
50 mL |
| m(混合物) |
9.2 g |
14.2 g |
27.6 g |
| V(CO2)(标准状况) |
2.24 L |
3.36 L |
3.36 L |
A.盐酸的物质的量浓度为3.0 mol/L
B.当混合物质量为9.2 g时,50 mL盐酸恰好完全反应
C.混合物中NaHCO3、KHCO3的物质的量之比为1∶2
D.混合物中NaHCO3的质量分数为45.7 %
如右图所示,杠杆AB两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 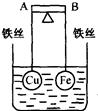
| A.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
| B.杠杆为导体和绝缘体时,均为A端高B端低 |
| C.杠杆为导体和绝缘体时,均为A端低B端高 |
D.当杠杆为绝缘体时,A端低,B 端高;为导体时,A端高,B端低 端高;为导体时,A端高,B端低 |
用铂电极电解100mL HNO3 与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
AgNO3的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Ag+的物质的量浓度为 ( )
A.1mol/L  |
B.2mol/L | C.2.5mol/L | D.3mol/L |
用惰性电极电解下列溶液一小段时间后,加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是()
| A.CuSO4 (CuSO4) | B.NaOH (NaOH) |
| C.NaCl (NaCl) | D.CuCl2(CuCl2 ) |
目前,人们正在研究开发一种高能电池---钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′—Al2O3陶瓷作固体电解质,反应式如下:Na2Sx 2Na+xS,以下说法正确的是()
2Na+xS,以下说法正确的是()
| A.放电时,Na 作正极,S极发生还原反应 |
| B.充电时钠极与外电源的正极相连 |
| C.当用该电池电解AgNO3溶液时,阳极上产生标况下气体11.2L时,消耗钠2.3g |
| D.充电时,阳极发生的反应为:Sx2--2e-=xS |
右图 为
为 直流电源,
直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.
后,使c、d两点短路.
下列叙述正确的是()
| A.a为直流电源的负极 |
| B.c极发生的反应为O2+4e-+2H2O=4OH- |
| C.f电极为铁板 |
| D.电解质溶液不能用CuCl2溶液 |