(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。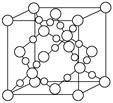
(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO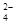 与PO
与PO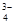 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
芳香化合物A、B互为同分异构体B的结构简式是CH3COO- -COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
-COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
(1)B可以发生的反应类型有(填序号)。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰。
(2)E中含有官能团的名称是。
(3)A有两种可能的结构,其对应的结构简式为,。
(4)B、C、D、F、G化合物中互为同系物的是。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为:
。
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)单质F的化学式为。 (2)溶液I中所含金属离子是。
(3)由E生成G的反应类型为,;
A和B的混合物称为。
(4)写出下列离子方程式: C+L;
H转变成I;
I转变成J;
(5)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)。
填空(3分)
| 硅酸盐 |
化学组成 |
氧化物形式 |
| 高岭土 |
Al2(Si2O5)(OH)4 |
|
| 正长石 |
K2Al2Si6O16 |
|
| 红柱石 |
Al2SiO5 |
现用10mol·L-1的浓硫酸来配制500mL 0.2 mol·L-1的稀硫酸,可供选择的仪器有:①玻璃棒 ②烧杯 ③胶头滴管 ④量筒 ⑤容量瓶 ⑥托盘天平⑦药匙
(1)上述仪器在配制过程中不需要用到的是_______________________。(填序号)
(2) 配制该溶液应选用 ml容量瓶
(3)计算所需浓硫酸的体积为___________。现有①10mL ②50mL ③100mL三种规格的量筒,应当选用_______________。(填序号)
(4)实验中两次用到玻璃棒,其作用分别是:___________、__________。
(5)配制时,一般可分为以下几个步骤:
①计算 ② 量取③稀释 ④____________ ⑤转移 ⑥洗涤 ⑦定容 ⑧摇匀。
(6)配制好的溶液 (填“能”或“不能”)长期存放在容量瓶中。
(5分)将氯气通入无色的饱和碘化钾溶液中,其离子方程式是,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显色,这种操作叫做。