现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
如图是稀酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果.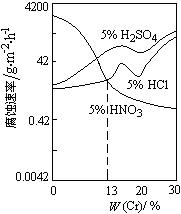
下列有关说法正确的是()
| A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 |
| B.稀硝酸和铁反应的化学方程式是Fe+6HNO3(稀)= Fe(NO3)3 + 3NO2↑+ 3H2O |
| C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |
| D.随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 |
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是()
| 选项 化合物 |
A |
B |
C |
D |
| Y |
CO2[ |
Fe2O3 |
C2H5OH |
FeCl3 |
| W |
MgO |
Al2O3 |
C2H5ONa |
CuCl2 |
X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是()
| A.X与W可以形成W2X、W2X2两种化合物 |
| B.Y元素最高价氧化物对应水化物的化学式为H2YO4 |
| C.原子序数由小到大的顺序为W<X<Y<Z |
| D.Y、Z两元素的简单离子的半径Y>Z |
某同学用量筒量取液体时,将量筒平放,仰视液体凹液面最低处读数为16.0mL,倾倒出一部分溶液,又俯视液体凹液面最低处,读数为10.0mL,该同学取出液体的体积是()
| A.大于6.0mL | B.等于6.0mL |
| C.小于6.0mL | D.无法判断 |
下列情况会对人体健康造成较大危害的是()
| A.自来水中通入少量氯气进行消毒杀菌 |
| B.用二氧化硫漂白食品 |
| C.用水玻璃制备木材防火剂 |
| D.用氢氧化铝作胃酸中和剂 |