.把V L含有 和
和 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 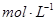 |
B. 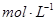 |
C. 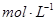 |
D. 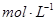 |
下列图示与对应的叙述不相符的是
| A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线 |
| B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 |
C.图3表示压强对可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的影响,乙的压强比甲的压强大 CO2(g)+H2(g)的影响,乙的压强比甲的压强大 |
| D.图4表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
下列说法中正确的是
| A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| B.升高NH4Cl溶液的温度,其水的离子积常数和pH均增大 |
| C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 |
| D.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
下列表示对应化学反应的离子方程式正确的是
| A.NO2通入水中:3NO2+H2O=2H++2NO3-+NO |
B.用两个铜电极电解CuSO4溶液:2Cu2++2H2O  2Cu↓+O2↑+4H+ 2Cu↓+O2↑+4H+ |
| C.SO2通入FeCl3溶液中:SO2+Fe3++2H2O=SO42-+Fe2++4H+ |
| D.过量的CO2通入NaAlO2溶液中:2AlO2-+CO2+3H2O =Al(OH)3↓+CO32- |
下列有关实验装置进行的相应实验,能达到实验目的的是
| A.图1定量测定H2O2的分解速率 |
| B.图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D.图4证明CH3CH2OH发生消去反应生成了乙烯 |