(14分)
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。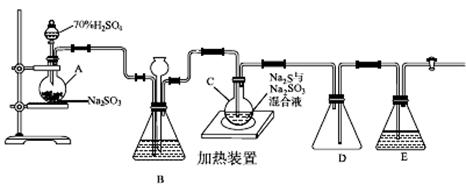
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O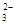 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
氢气在氯气中燃烧时产生的苍白色火焰。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1 kJ,断裂1molCl2中的化学键消耗的能量为Q2 kJ,形成1molHCl中的化学键释放的能量为Q3 kJ,则Q1+ Q22 Q3(填“<”“>”“=”)。
在下列物质中:①碘单质②烧碱晶体③N aCl晶体④干冰⑤固态氯化氢。用序号填写下列空白:
aCl晶体④干冰⑤固态氯化氢。用序号填写下列空白:
(1)既含有离子键又含有共价键的化合物是 。
。
(2)含有离子键的化合物是 。
。
(3)仅含有共价键的单质是 。
。
请用元素符号(或化学式)回答原子序数11-18的元素有关问题:
(1)除稀有气体外,原子半径最大的是。
(2)最高价氧化物的水化物中碱性最强的是。
(3)最高价氧化物的水化物中呈两性的是。
(4)最高价氧化物的水化物中酸性最强的是。
(5)气态氢化物中最稳定的是。
在63Li、147N、2311N a、2412Mg、73Li、146C中,和互为同位素。表示核素的符号共种。
a、2412Mg、73Li、146C中,和互为同位素。表示核素的符号共种。
有机物A的结构简式为:
(1)A的分子式为____________________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 molA发生反应时,最多消耗_________ mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为___________________________________________________________________。
(4)写出苯环上只有 一个取代基且属于酯类的D的所有同分异构体的结构简式。
一个取代基且属于酯类的D的所有同分异构体的结构简式。
(5)D的某同系物在氧气中充分燃烧生成二氧化碳和水,其中n(CO2)∶n(H2O)=3∶2,该同系物的分子式为_______________________。