美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意如下图,下列说法正确的是
| A.a极为电池的正极 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e=2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
(3分)下列有关实验的叙述中,合理的是__________
A实验室中少量金属钠、钾保存在汽油中
B容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
C圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
D用一定浓度的盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管记录起始体积时,平视读数,终点时俯视,所测碱的浓度偏高
E.不用其它化学试剂即可鉴别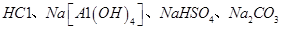 四种无色溶液
四种无色溶液
F.可以用渗析的方法除去淀粉溶液中的氯化钠
常温下,向l00 mL 0.01 mol/LHA溶液中逐滴加入0.02 mol/LMOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是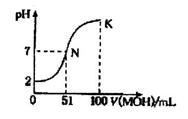
| A.HA为一元强酸,MOH为一元强碱 |
| B.K点所示溶液中c(A-)>c(M+) |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:
下列说法正确的是
| A.Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl |
| B.相同条件下电离程度比较:HCO3->HSO3->HClO |
| C.6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
| A.还原性:I->Fe2+>Br- |
| B.线段AB表示Fe2+被氯气氧化 |
| C.线段BC表示生成4 mol Fe3+ |
D.原溶液中n ( )="6" mol )="6" mol |
将下图所示实验装置的K闭合,下列判断正确的是
| A.Cu电极上发生还原反应 |
B.电子沿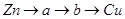 路径流动 路径流动 |
C.片刻后甲池中 增大 增大 |
| D.片刻后可观察到滤纸b点变红色 |