高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4 2H++S
2H++S
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
| A.原子半径:W>Z>Y>X | B.气态氢化物的稳定性:X<Z |
| C.最外层电子数:Y>W | D.Y、Z的氧化物都是两性氧化物 |
室温下用下列实验装置进行相应实验,能达到实验目的的是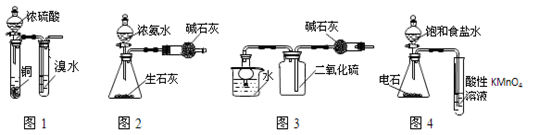
| A.图1:验证浓硫酸具有强氧化性 |
| B.图2:制取干燥的NH3 |
| C.图3:干燥、收集并吸收多余SO2 |
| D.图4:验证乙炔的还原性 |
某芳香族化合物甲的分子式为C10H11ClO2,已知苯环上只有两个取代基,其中一个取代基为—Cl,甲能与饱和碳酸氢钠溶液反应放出二氧化碳,则满足上述条件的有机物甲的同分异构体数目有多少种
| A.5种 | B.9种 | C.12种 | D.15种 |
设NA代表阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,18g H218O所含质子数为10NA |
| B.1mol的—OH与1mol的OH—所含电子数均为10NA |
| C.常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA |
| D.Na2O2与H2O的反应中,每生成0.1mol O2,转移电子数目为0.4NA |
化学与生活、社会发展息息相关,下列有关说法不正确的是
| A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 |
| B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 |
| C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 |
| D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |