某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.B、C两点的平衡常数K(B)K(C)(填“>”、“=”或“<”).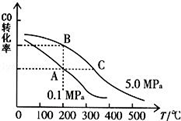
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得
c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小排列顺序____________
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为__________ .
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是 .
有机物A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):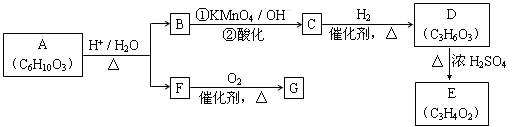
已知: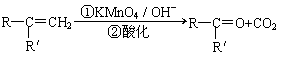 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
请回答:
(1)F蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量钠作用产生H2 22.4 L(标准状况),则F的分子式是________________。
(2)G与F的相对分子质量之差为4,则G的性质是________(填字母)。
a.可与银氨溶液反应
b.可与乙酸发生酯化反应
c.可与氢气发生加成反应
d.1 mol G可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________
(4)B的同分异构体较多,写出一种不含甲基能发生银镜反应的同分异构体结构简式: ____________。
(5)A转化为B和F的化学方程式是__________________。
(6)某烃分子H的碳原子数小于10,核磁共振氢谱只有一组峰, 在相同条件下也可发生类似B → C的反应并只生成一种有机物I,I的结构简式: ___________。
(16分)柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。下图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】:
①柠檬酸水溶液显酸性,柠檬酸钙不溶于水;
②工业生产柠檬酸,原料预处理后,得到的发酵液中
含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
… |
| 溶解度/g |
96 |
118 |
146 |
183 |
216 |
… |
④某种专用树脂对柠檬酸的吸附率和水温的关系如图:
【钙盐法制备】
(1)气体X是 (填化学式),实验室检验该气体的化学方程式为 ;
(2)操作1、2的名称是 ;
(3)操作3的目的是得到一水柠檬酸晶体,操作顺序是b → → a;(填序号)
a.过滤b.加热浓缩 c.冷却结晶 d.蒸发结晶
(4)工业生产中,可加入 (填序号)进行脱色处理;
A.活性炭B.明矾C.肥皂水
(5)洗涤CaSO4滤渣的目的是 ;
(6)母液可以循环,其中一定含有的溶质是 ;
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置___________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为_______ _;
该化合物和单质F反应的离子方程式为_______________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为_____ ___。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为____________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为 __。
向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
(1)若t1=15s,则t0~t1阶段v(C)=______ _,A的转化率为______ __。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式 。
(3)若t4时改变的条件为减小压强,则B的起始物质的量浓度为____ _mol/L。
(4)t3时改变的某一反应条件可能是_______ _(选填序号)。
a.使用催化剂b.增大压强 c.增大反应物浓度