溶度积常数表达式符合Ksp=·c(By-)的是( )
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是

图1 A的核磁共振氢谱图2 B的核磁共振氢谱
A.A是C3H6;B是C6H6B.A是C3H6;B是C2H6
C.A是C2H6;B是C6H6D.A是C2H6 ;B是C3H6
下列烷烃: ①正已烷 ②丙烷 ③正戊烷 ④异戊烷 ⑤癸烷中,沸点由高到低顺序正确的是
| A.①②③④⑤ | B.⑤①③④② | C.⑤③④①② | D.⑤①④③② |
设阿伏加德罗常数为NA,则下列说法正确的是
| A.1.5g甲基(—CH3)所含有的电子数是NA |
| B.1mol 1,3一丁二烯分子中含有的碳碳双键数为NA |
| C.标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA |
| D.常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |
下列化学用语正确的是
A.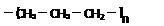 聚丙烯的结构简式为: 聚丙烯的结构简式为: |
B.丙烷分子的比例模型为: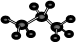  |
C.四氯化碳分子的电子式为: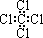 |
| D.CH2=C(C2H5)—CH=CH2的名称是:2—乙基—1,3—丁二烯 |
近期我国冀东渤海湾发现储量达10亿吨的大型油田。下列关于石油的说法正确的是
| A.石油属于可再生矿物能源 | B.石油的裂化是物理变化 |
| C.石油主要含有碳、氢两种元素 | D.石油分馏的各馏分均是纯净物 |