下列说法正确的是( )
| A.向饱和食盐水中加入少量的浓盐酸,看不到明显的现象 |
| B.将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小 |
| C.在0.01 mol·L-1 NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解 |
D.CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3 Ca2++ CO32- Ca2++ CO32- |
已知:2CO(g)+O2(g)=2CO2(g)ΔH=" --" 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g) ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )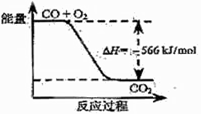
| A.CO的燃烧热为283 kJ |
| B.右图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH< --452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
在同温同压下,下列各组热化学方程式中△H1>△H2的是()
| A.2H2(g)+ O2(g)="=" 2H2O(l);△H1 2H2(g)+ O2(g)="=" 2H2O(g);△H2 |
| B.2S(g)+ O2(g) ="=" 2SO2(g);△H1 2S(s)+ O2(g) ="=" 2SO2(g);△H2 |
| C.C(s)+1/2O2(g)="=" CO(g);△H1C(s)+ O2(g)="=" CO2(g);△H2 |
| D.H2(g)+ Cl2(g)="=" 2HCl(g);△H11/2H2(g)+ 1/2Cl2(g)="=" HCl(g);△H2 |
已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH=-Q1 kJ/mol;
2H2(g)+O2(g) ==2H2O(g)ΔH=-Q2 kJ/mol;
H2O(g) ==H2O(l)ΔH=-Q3 kJ/mol
常温下取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
已知:2H2(g)+ O2(g)=2H2O(l) ΔH=-571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH=-890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是( )
| A.1∶1 | B.1∶3 | C.1∶4 | D.2∶3 |
为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
| A.甲 | B.乙 | C.丙 | D.上述实验方案都不正确 |