某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之比接近3∶1
A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中A是单质,B在常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是( )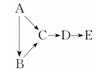
A.A不可能是金属
B.由C生成D肯定发生了电子转移
C.A生成C肯定属于离子反应
D.B和E可能会发生反应生成一种盐
不能只用NaOH溶液除去括号中杂质的是()
| A.Mg(Al2O3) | B.MgCl2(AlCl3) | C.Fe(Al) | D.Fe2O3(FeO) |
有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:
Zn+2OH—-2e—=ZnO+H2O;Ag2O+H2O+2e—=2Ag+2OH—,总反应式:Ag2O+Zn=ZnO+2Ag
根据上述反应式,判断下列叙述中正确的是
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.在使用过程中,电子由Ag2O极流向Zn极 |
| C.Zn是正极,Ag2O是负极 |
| D.Zn极发生还原反应,而Ag2O极发生氧化反应 |
下列反应的离子方程式正确的是
| A.CaCO3与稀HCl反应制备CO2:CO32-+2H+=H2O+CO2↑ |
| B.Na2O2与水反应:2Na2O2+2H2O==4Na++4OH-+O2↑ |
C.金属铝溶于氢氧化钠溶液: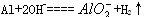 |
| D.稀硝酸和过量的铁屑反应: Fe +4H+ + NO3- = Fe3+ + NO↑ + 2 H2O |
“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。以下反应最符合绿色化学,原子经济性要求的是
| A.乙烯聚合为聚乙烯高分子材料 | B.甲烷与氯每题有1-气制备一氯甲烷 |
| C.以铜和浓硝酸为原料生产硝酸铜 | D.用乙烯水化得乙醇 |