下列关于电解池的叙述中正确的是( )
| A.电解池中的闭合回路仅是由电子的定向移动形成的 |
| B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C.在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动 |
| D.相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相等 |
下列反应中,属于消去反应的是( )
| A.溴乙烷与NaOH水溶液混合加热 |
| B.一氯甲烷与KOH的乙醇溶液混合加热 |
| C.氯苯与NaOH水溶液混合加热 |
| D.2溴丁烷与KOH的乙醇溶液混合加热 |
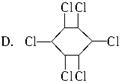
六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。下式中能表示六氯苯的是( )
萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2-硝基萘,则化合物(Ⅲ)的名称应是( )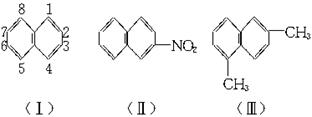
| A.2,6-二甲基萘 |
| B.1,4-二甲基萘 |
| C.4,7-二甲基萘 |
| D.1,6-二甲基萘 |
在某一温度下,将20 g乙炔、30 g苯乙烯,依次溶于40 g苯中,所得混合溶液中氢元素的质量分数是( )
| A.7.7% | B.7.9% | C.15.4% | D.15.8% |
已知苯跟一卤代烷在催化剂作用下,可生成苯的同系物。如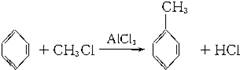 在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
在催化剂作用下,由苯和下列各组物质合成乙苯最好应选用的是( )
| A.CH3—CH3和Cl2 | B.CH2==CH2和Cl2 |
| C.CH2==CH2和HCl | D.CH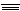 CH和Cl2 CH和Cl2 |