根据碘与氢气反应的热化学方程式
(1)I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ
2HI(g) ΔH=-9.48 kJ
(2)I2(s)+H2(g) 2HI(g) ΔH=26.48 kJ
2HI(g) ΔH=26.48 kJ
下列判断正确的是( )
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
下列各组顺序的排列不正确的是
| A.离子半径:Na+>Mg2+>Al3+>F— | B.热稳定性:HCl>H2S>PH3>AsH3 |
| C.酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4 | D.熔点:SiO2>NaCl>Na>CO2 |
已知下列元素原子的半径为:
| 原子 |
N |
S |
O |
Si |
| 半径r/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m
某同学所做实验如图所示,向小试管中加入生石灰固体,充分反应后,U型管中a液面会下降,关于小试管内的化学反应说法正确的是
①该反应为放热反应②生成物的总能量比反应物的总能量高③该反应过程可以看成是“贮存”于反应物中的能量部分转化为热量而释放出来
| A.①② | B.①③ | C.①②③ | D.③ |
对于达到平衡状态的可逆反应:N2 +3H2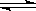 2NH3,下列有关叙述正确的是
2NH3,下列有关叙述正确的是
| A.N2和NH3的质量分数相等 | B.N2、H2、NH3的浓度之比为1:3:2 |
| C.反应物和生成物浓度不再发生变化 | D.正反应和逆反应不再进行 |
根据叙述判断下列各元素一定属于主族元素的是
| A.元素的原子最外层电子数为2 | B.元素的原子最外层电子数为6 |
| C.位于元素周期表中ⅡA族右边的元素 | D.阴离子RO4—中R元素 |