用NA表示阿伏加德罗常数,下列说法中正确的是
| A.足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2为0.1NA |
| B.78 g苯含有碳碳双键的数目为3NA |
| C.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.1NA |
| D.25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA |
科学家发现一种化学式为H3的氢分子。1 mol H3和1 mol H2 具有相同的
| A.分子数 | B.原子数 | C.质子数 | D.电子数 |
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可以将它们鉴别出来,这种试剂是
| A.H2SO4 | B.NaOH | C.BaCl2 | D.KSCN |
正确的实验操作是实验成功的基本保证。下列实验操作正确的是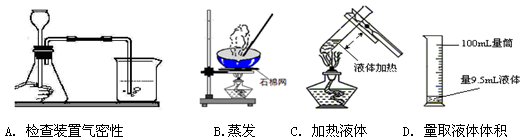
下列物质的性质或用途正确的是
| A.二氧化硅是制造太阳能电池的常用材料 |
| B.硅可以用来做光导纤维 |
| C.小苏打和氢氧化铝均可治疗胃酸过多 |
| D.NO是红棕色气体 |
以惰性电极电解CuSO4和NaCl的混合溶液,两电极上产生的气体(标准状况下测定)体积如下图所示,下列有关说法正确的是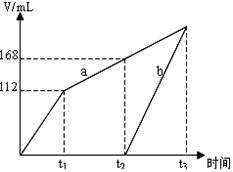
| A.a表示阴极上产生的气体,t1前产生的为Cl2 |
| B.原溶液中CuSO4和NaCl物质的量之比为1:1 |
| C.若t2时溶液的体积为1 L,此时溶液的pH为13 |
| D.若原溶液体积为1 L,则原溶液中SO42-的物质的量浓度为0.2 mol/L |