醋酸是一种常见的弱酸。
(1)假如某醋酸溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为
mol/L;计算此时醋酸的电离平衡常数,写出计算过程。[注: c平衡(CH3COOH)≈0.10mol/L,水的电离可忽略不计]
(2)为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,准备了以下化学用品:0.20 mol·L-1与0.40 mol·L-1的HCl溶液、0.20 mol·L-1与0.40 mol·L-1的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298 K和308 K。
①酸液都取足量、相同体积,请你帮助完成以下实验设计表:
| 实验 编号 |
温度 (K) |
盐酸浓度 (mol·L-1) |
醋酸浓度 (mol·L-1) |
实验目的 |
| a |
298 |
0.20 |
|
I.实验a和b是探究 对镁与盐酸反应速率的影响; II.实验a和c是探究 对镁与盐酸反应速率的影响; III.实验a和d是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别 |
| b |
308 |
0.20 |
|
|
| c |
298 |
0.40 |
|
|
| d |
|
|
|
②若①中实验a镁条消失的时间是20 s,则镁条剩余质量与时间关系图如下图。假设:该反应温度每升高10 ℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在此图中大致画出“实验b”、“实验d”的镁条剩余质量与时间关系曲线,请注意必要的标注。
(3)镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:
已知:①Mg(s)+2H2O(g)===Mg(OH)2(s)+H2(g) ΔH1=-441 kJ·mol-1
②H2O(g)===H2(g)+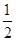 O2(g) ΔH2=+242 kJ·mol-1
O2(g) ΔH2=+242 kJ·mol-1
③Mg(s)+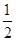 O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
O2(g)===MgO(s) ΔH3=-602 kJ·mol-1。
则氢氧化镁分解的热化学方程式是 。
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
(1)图中所示反应是_________(填“吸热”或“放热”,1分)反应,该反应________(填“需要”或“不需要”,1分)加热,该反应的△H=____________(用含E1、E2的代数式表示,1分)。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.5 kJ/mol,该反应的活化能为167.4 kJ/mol,则其逆反应的活化能为_________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_____________________。
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域。在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如 。若同一个碳原子上连着2个碳碳双键(如C="=C==C" )时,极不稳定,因此这种结构不存在。某链烃C7H10的众多同分异构体中:
。若同一个碳原子上连着2个碳碳双键(如C="=C==C" )时,极不稳定,因此这种结构不存在。某链烃C7H10的众多同分异构体中:
(1)处于同一平面上的碳原子数最多有_______。
| A.6个 | B.5个 | C.7个 | D.4个 |
(2)含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有5种。它们的结构简式除以下3种外,还有_______、_______。
①
②
③
(3)含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是_________________。
军事上的“地表伪装”是使军事保护的外观色彩、红外反射与环境吻合。BASF是在20世纪70年代开发的苝系新型红外伪装还原染料,该染料为橄榄色或黑色。其化学结构为: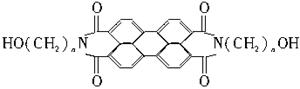
请完成下列问题:
(1)染料BASF的分子式可表示为C2n+24HxN2O6,则x=_________。
(2)1 mol该物质与Na反应产生氢气的量及在催化剂作用下加成所需氢气的量,其最大值(物质的量)分别为_________、_________。
(3)当n=3时,其中碳原子上的一氯取代物可能有_________种。
A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是__________________,其结构简式是__________________。
(2)写出所有满足下列3个条件的A的同分异构体的结构简式:①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是________________________________________________________________________。
某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量是___________________。
(3)该化合物的化学式(分子式)是__________________。
(4)该化合物分子中最多含_________个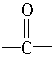 官能团。
官能团。