氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁,实验室制备氯化铁的装置如下图:(已知:废铁屑中的杂质不与盐酸反应)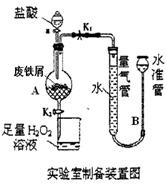
(1)实验制备操作步骤如下:
Ⅰ.打开弹簧夹 (填“K1”或“K2”),关闭弹簧夹 (填“K1”或“K2”),并打开活塞a,缓慢滴加盐酸。
Ⅱ.当 时,关闭弹簧夹K1,打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液经过 操作后得到FeCl3·6H2O晶体。
Ⅳ.最后将FeCl3·6H2O晶体制成无水氯化铁。
(2)当盐酸与A中废铁屑接触后发生的化学反应方程式是: 。
(3)写出H2O2溶液中发生的反应的离子反应方程式: 。
(4)铁制品易生锈,采用电化学防腐的方式可以防止铁制品生锈,请利用石墨为辅助电极材料,完成铁制品防腐示意图,并做相应标注。
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。
I.尼泊金丙酯( )已被国家质量监督检验检疫总局禁止作为食品添加剂使用,下列关于它的说法错误的是。
)已被国家质量监督检验检疫总局禁止作为食品添加剂使用,下列关于它的说法错误的是。
| A.在核磁共振氢谱中能出现6组峰 |
| B.一定条件下,1 mol该物质能与4 mol H2发生加成反应 |
| C.与NaOH溶液反应,1 mol该物质最多消耗1 mol NaOH |
| D.最多有10个碳原子共平面 |
Ⅱ.合成高分子树脂F的路线如下图所示:
已知:
回答下列问题:
(1)A中官能团的名称为。
(2)B→C的反应类型为。
(3)C的结构简式为。
(4)写出E→F反应的化学方程式。
(5)已知碳碳双键能被O2氧化,则上述流程中“B→C”和“D→E”两步共同所起的作用是。
I.下列说法中正确的是。
| A.第一电离能由大到小的顺序为O>N>C |
B.由于C 和O 和O 互为等电子体,所以可以推断O 互为等电子体,所以可以推断O 的电子式为 的电子式为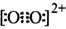 |
| C.根据岩浆晶出规则,Ca0比Mg0更容易在岩浆冷却过程中先结晶 |
| D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
Ⅱ.(1)兰聚氰胺分子的结构简式如图所示,则其中氮原子轨道杂化类型是,l mol三聚氰胺分子中含mol 键。
键。 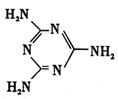
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____。
(4)碳化硅的晶胞结构(如右图)与金刚石类似(其中“●”为碳原子,“○”为硅原子)。图中“●”点构成的堆积方式与下列图式中所表示的堆积方式相同。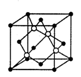
(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有个。设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为(用含a、b、c的式子表示)。
Ⅰ下列说法不正确的是____。
| A.可以利用某些炼钢废渣来生产磷肥 |
| B.具有永久硬度的水主要用加热的方法来进行软化 |
| C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量 |
| D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳 |
Ⅱ下图是某工厂对海水资源进行综合利用的示意图。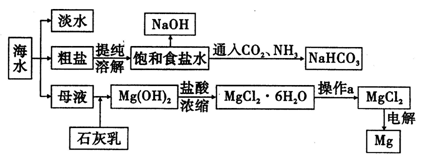
请回答下列问题:
(1)用离子交换膜电解饱和食盐水时,精制的饱和食盐水应该加入到极室。
(2)已知在离子交换膜电解槽中,理论上每小时通过1安培的直流电,每槽可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342×103 kg/m3)113 m3,电解槽的电流强度1.45×l04 A,该电解槽的电解效率为。
(3)示意图中制取NaHC03的化学方程式为。
(4)有人提出直接加热Mg(OH)2得到Mg0,再电解熔融Mg0得金属Mg,这样可简化流程。请判断该方案是否可行,并说明理由。
下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。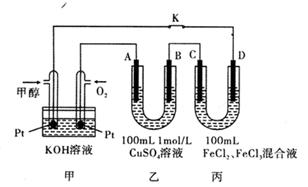
(1)甲中负极的电极反应式为____。
(2)乙中A极析出的气体在标准状况下的体积为____。
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要mL 5.0 mol/L NaOH溶液。