聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) |
Ala/% |
Alb/% |
A1c/% |
| 0.208 |
1.4 |
86.6 |
12.0 |
| 0.489 |
2.3 |
86.2 |
11.5 |
| 0.884 |
2.3 |
88.1 |
9.6 |
| 1.613 |
3.1 |
87.0 |
9.9 |
| 2.520 |
4.5 |
88.2 |
7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g) △H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式 。
(1)据报道以硼氢化合物NaBH4(H的化合价为-1价) 和 H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。写出该电池放电时负极的电极反应式:。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l) + O2(g) = N2(g)+ 2H2O(l)△H =" –" 534 kJ·mol—1
H2O2(l)= H2O(l) + 1/2O2(g) △H =" –" 98.6 kJ·mol—1
写出常温下,N2H4(l) 与H2O2(l)反应生成N2和H2O的热化学方程式:。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。
①图中阴极为(填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:。
(4)向一密闭容器中充入一定量的一氧化碳和水蒸气,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
CO2(g)+H2(g),下列情况下能判断该反应一定达到平衡状态的是_______(选填编号)。
| A.v正(H2O) = v逆(H2) |
| B.容器中气体的压强不再发生改变 |
| C.H2O的体积分数不再改变 |
| D.容器中CO2和H2的物质的量之比不再发生改变 |
E.容器中气体的密度不再发生改变
(5)温度T1时,在一体积为2L的密闭容积中,加入0.4molCO2和0.4mol的H2,反应中c(H2O)的变化情况如图所示,T1时反应CO(g)+H2O(g) CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
CO2(g)+H2(g)第4分钟达到平衡。在第5分钟时向体系中同时再充入0.1molCO和0.1molH2(其他条件不变),请在右图中画出第5分钟到9分钟c(H2O)浓度变化的曲线。
(16分)尼泊金甲酯和香兰素在食品、化妆品行业有广泛用途。它们的结构简式如下:
(1)尼泊金甲酯中显酸性的官能团是__________(填名称)。
(2)下列说法中,正确的是______(填标号)。
| A.尼泊金甲酯和香兰素分子式都是C8H8O3 |
| B.尼泊金甲酯和香兰素都能发生水解反应 |
| C.1 mol尼泊金甲酯或香兰素均能与4 mol H2发生加成反应 |
| D.利用银氨溶液可以区别尼泊金甲酯和香兰素 |
(3)写出尼泊金甲酯与NaOH溶液反应的化学方程式:_________________________________。
(4)大茴香酸与香兰素互为同分异构体,它是一种羧酸,且具备以下3个特点。大茴香酸的结构简式为______________________。
a.分子中含有甲基
b.遇FeCl3溶液不显紫色
c.苯环上的一氯代物只有两种
(5)以丁香油酚为原料,通过下列路线合成香兰素。
(注:分离方法和其他产物已经略去;乙酸酐的结构简式为:(CH3CO)2O)
①由 和ClCH2CH==CH2合成丁香油酚的反应类型为____________。
和ClCH2CH==CH2合成丁香油酚的反应类型为____________。
②步骤Ⅱ中,反应的化学方程式为____________________________________。
③W的结构简式为________________。
选考(12分)【化学一物质结构与性质】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)镓的基态原子的电子排布式是__________________________。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为________(用元素符号表示)。
(3)气态SeO3分子的立体构型为____________________。
(4)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是________________。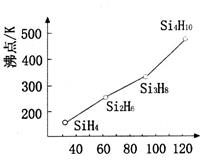
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为________________;若该晶体的边长为a cm,则该合金密度为____________g·cm-3(阿伏加德罗常数的值为NA)。
选考(12分)【化学——化学与技术】
(1)目前,我国采用“接触法”制硫酸。有关接触法制硫酸的下列说法中,正确的是_________。
| A.二氧化硫的接触氧化在转化器中发生 |
| B.吸收塔中得到的硫酸质量分数为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
| D.转化器中适宜条件是V2O5,催化剂、高温、常压 |
E.转化器中采取高温是为了提高催化剂的活性和提高SO2的转化率
(2)硫酸工厂排放的尾气中含少量二氧化硫。为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的SO2可用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程发生反应的化学方程式:_____________;
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰_____________Kg。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图所示,a、b离子交换膜将电解槽分为三个区域,电极材料为石墨。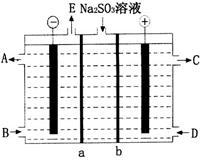
①图中b表示__________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中C为硫酸,则E表示__________;
②阳极的电极反应式为________________。
(17分)碳及其化合物与人类生产、生活密切相关。(1)在化工生产过程中,少量CO的存在会引起催化剂中毒,为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。
已知:C(s)+1/2O2(g)=CO(g)△H1=-126.4kJ·mol-1
C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
S(s)+O2(g)=SO2(g) △H3=-296.8kJ·mol-1
则SO2氧化CO的热化学反应方程式为____________。
(2)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)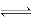 CH3OH(g) △H=-90.8KJ·mol-1。
CH3OH(g) △H=-90.8KJ·mol-1。
①在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系,则曲线Z对应的温度是______℃;该温度下上述反应的化学平衡常数为_______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________;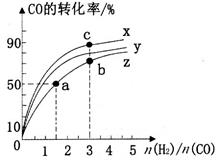
②在密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状。当改变某一反应条件后,下列变化能说明平衡一定向正反应方向移动的是______(填序号)。
| A.正反应速率瞬间增大,后逐渐减小 |
| B.混合气体的密度增大 |
| C.化学平衡常数K值增大 |
| D.反应物的体积百分含量增大 |
(3)一种新型CO燃料电池工作原理如图所示。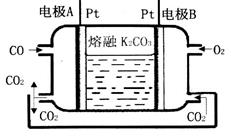
①负极电极反应式为_______________________;
②电极A处产生的CO2有部分参与循环利用,其利用率为____________。