短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍, A与D可以形成原子个数比分别为1:1和2:1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,E的原子结构示意图是_____ 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是__________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式____ ____ ____ ____ ____ ____ 。
②上述反应生成的两种碱继续作用,得到Fe3O4
(5)已知下表数据:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
2.0×10-16 |
4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式: 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有.
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。并用单线桥表示电子的转移情况 。
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g)△H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g)△H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
周期表前四周期的元素Q、R、X、Y、Z原子序数依次增大,Q元素的原子形成的离子就是一个质子;R基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;X基态原子s能级的总电子数比p能级的总电子数多1;Y原子的核外成对电子数是未成对电子数的3倍;Z原子的价电子排布为3d74S2。
回答下列问题:
(1)R、X、Y中第一电离能最大的是 (填元素符号),其中Y原子的电子排布式为 。
(2)Q、R元素形成的某分子中共有14个电子,该分子中R原子采取 杂化,该分子的立体构型为 。
(3)RY可以和很多过渡金属形成配合物,如Fe( RY)5、Ni(RY)4。其中Fe(RY)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe (RY)5晶体属于 (填晶体类型)。RY与N2互为等电子体,与RY互为等电子体的离子有 (任写一种)。
(4)向含Z2+的溶液中加入过量的氨水,并通入适量的Y2气体,生成有[Z(NH3)6]3+离子,则该反应的离子方程式为 。
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图:
2NH3(g ) △H<0,反应中NH3的物质的量浓度变化情况如右图: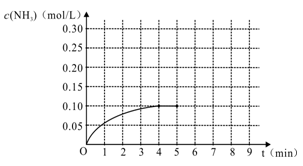
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为____________mol/(L·min)。
(2)该反应的化学平衡常数表达式K_____________,随温度的升高,K值将 (填“增大”、“减小”“不变”)
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______________。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/LD. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数___________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
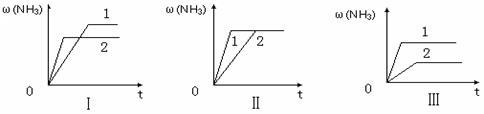
(6)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2