两种硫酸盐按一定比例混合后共熔,可制得化合物X且X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2 Cr3++3I2+7H2O 。若向溶有2.83 gX的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为
| A.K2SO4 ·2Cr2(SO4)3 | B.2K2SO4 ·Cr2(SO4)3 |
| C. K2SO4 ·Cr2(SO4)3 | D.K2SO4 ·1/2Cr2(SO4)3 |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③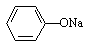 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)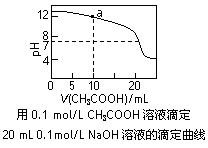
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+ H2O(未配
H2O(未配 平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是()
平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是()
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、
Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH>7。
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后
CCl4层呈橙色,用分液漏斗分液。
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白 色沉淀产生。
色沉淀产生。
则关于原溶液的判断中不正确的是
| A.肯定存在的离子是Na+、K+、SO32-、Br- |
| B.肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- |
| C.无法确定原溶液中是否存在Cl- |
| D.若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是 
A.D、E中一定都含有A的元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解, 所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |