现有下列四组溶液,每组包括三种溶液并按A、B、C顺序排列:
| |
甲 |
乙 |
丙 |
丁 |
| A |
BaCl2 |
Na2CO3 |
KCl |
K2CO3 |
| B |
硝酸 |
硝酸 |
盐酸 |
盐酸 |
| C |
Na2CO3 |
AgNO3 |
K2CO3 |
BaCl2 |
请根据下列操作中所观察的现象回答:
向CaCl2溶液中加入A溶液产生白色沉淀;继续加入过量的B溶液沉淀消失,并产生无色无味的气体;再加入少量的C溶液,又生成白色沉淀。
(1)上述操作过程中,选用了 组溶液。
(2)依据反应现象依次写出有关反应的化学方程式:
① 。
② 。
③ 。
取两支试管,分别加入4mL0.01mol/L的KMnO4溶液,然后向试管①中加入0.1mol/LH2C2O4溶液2mL,记录溶液褪色所需的时间;向试管②中加入0.2mol/L H2C2O4溶液2mL,记录溶液褪色时间,(1)实验表明褪色更快些。
(2)写出反应的化学方程式。
(3)在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2-② K+、Fe2+、I-、SO42-③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-⑤ K+、Ba2+、Cl-、NO3-⑥C2O42-、Br-、K+、Cl-
(1)向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7,(填>、=、<,下同)离子反应总方程式为。
(2)向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的 pH7,离子反应总方程式为 。
。
化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2•2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因:。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式:。
 在一定体积的密闭容器中,进行如下化学反
在一定体积的密闭容器中,进行如下化学反 应:
应:
CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。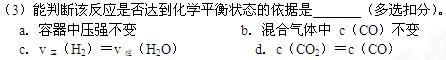
恒温恒压下,在一个可变容积的容器中发生如下反应: A(g) + B(g) 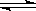 C(g)
C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时A的物质的
量为mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为mol
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,C的物质的量是3amol,x=mol.
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量是 mol.
mol.