有15 g Na2O2、Na2O、NaOH的混合物与400 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为 ( )
| A.23.4 g | B.25.5 g | C.31 g | D.无法计算 |
下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含有一个极性键的18电子粒子 |
| C.CH2Cl2和CCl4均是四面体构型的非极性分子 |
D.1 mol  DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图示:关于咖啡鞣酸的下列叙述不正确的是( )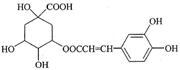
| A.分子式为C16H18O9 |
| B.与苯环直接相连的原子都在同一平面上 |
| C.1 mol咖啡鞣酸水解时可消耗8mol NaOH |
| D.与浓溴水既能发生取代反应又能发生加成反应 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C. 30 mL | D. 15 mL |
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是()
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 |
C6H5ONa溶液 |
| B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
| D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为()
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |