某同学欲测定Na2CO3和NaCl固体混合物中Na2CO3的质量分数,分别取ag样品,按下列方案进行实验,合理的是 ( )
| A.与足量稀盐酸充分反应,用排水法收集到VmL气体 |
| B.与足量稀盐酸充分反应,称量反应后的溶液,质量为m1g |
| C.与足量Ca(OH)2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体 |
| D.与足量浓盐酸充分反应,逸出的气体用NaOH固体充分吸收,固体质量增加m3g |
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是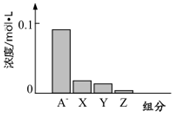
| A.将HA加水稀释,溶液中所有粒子的浓度均减小 |
| B.等浓度的HA和NaOH溶液中水的电离程度相同 |
| C.图中X表示HA,Y表示H+,Z表示OH- |
D.该混合溶液中: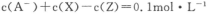 |
国庆节期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,下列关于该物质的说法正确的是
| A.其分子式为C15H21O4 |
| B.该有机物能发生取代、加成和水解反应 |
| C.1mol的该有机物与足量的钠反应产生1molH2 |
| D.该有机物不能使酸性KMnO4溶液褪色 |
关于下列图示的说法中正确的是
| A.图①装置用于分离沸点相差较大的互溶液体混合物 |
| B.图②装置用于研究不同催化剂对反应速率的影响 |
| C.图③中电流计的指针不发生偏转 |
D.对反应: ;根据图④可以求出x=2 ;根据图④可以求出x=2 |
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是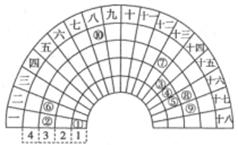
| A.⑥、⑧、⑨对应单核离子的半径依次增大 |
| B.⑤的三种核素的化学性质不相同 |
| C.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物 |
| D.⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
一定条件下,等物质的量的下列物质分别与足量的浓盐酸反应,产生Cl2的物质的量最多的是
| A.MnO2 | B.KClO3 | C.KMnO4 | D.Ca(ClO)2 |