某校研究性学习小组同学对经初步净化处理的浓缩海水(主要含NaCl和MgSO4)进行研究。
(1)实验时若需要配制1 000 mL 0.20 mol·L-1NaOH溶液,则需要称量固体NaOH的质量为 g。
(2)取初步净化处理的浓缩海水100 mL,加入200 mL 0. 20 mol·L-1NaOH溶液,恰好把其中的Mg2+完全沉淀,则浓缩海水中Mg2+的物质的量浓度为 。
(3)研究小组同学把上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,可得标准状况下Cl2的体积为 L。
【化学选修5有机化学基础】2011年4月台湾曝出的增塑剂风波一度让人们“谈塑色变”。常用的增塑剂如下:
请回答下列问题:
(1)下列对甲的叙述正确的是 (填选项字母)
| A.甲能使Br2的CCl4溶液退色 |
| B.甲的单体是CH3CH = CHCOOCH2CH2CH3 |
| C.1 mol甲能与1 mol NaOH发生水解反应 |
| D.甲能发生酯化反应、取代反应、消去反应、加成反应 |
(2)丙中含有的官能团名称是 。
(3)乙的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式 。
(4)已知通过燃烧法确定丁的含氧量(质量分数)为23%。以某烃A为原料合成该塑料增塑剂的流程如下:
①反应1的反应条件是 。
②反应2的反应类型是 。
③反应3的化学方程式是 。
【化学选修3物质结构与性质】有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小。围绕上述元素,回答下列问题:
(1)Q的电子排布图为 ,YQ3中心原子的杂化类型为 ,除X外,其余元素的第一电离能由小到大顺序为 (元素符号回答)。
(2)X2P和ZP2固态时均为分子晶体,但熔点X2P比ZP2高得多,原因是 。
(3)固体A是离子晶体,结构类似于CsCl,组成中含W的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体。该物质的电子式 ,其与水反应的化学方程式为 。
(4)Z单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图,计算晶体中Z原子的空间利用率为 ( )。
)。
节能减排已经成为全社会的共识,浙江省在原先推行乙醇汽油的基础上,开始试点甲醇汽油(即在汽油中添加一定量的甲醇),根据检测的数据分析认为,若宁波全市的140余万辆机动车全部使用甲醇汽油,一年内能减少有害气体(一氧化碳)排放将近100万吨。甲醇常利用煤气化过程中生成的CO和H2来制备:CO+2H2 CH3OH。请根据图示回答下列:
CH3OH。请根据图示回答下列:
(1)关于该反应的下列说法中,正确的是 (填字母):
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2,净测得CO和CH3OH(g)的浓度随时间变化如(图1)所示。从反应开始到平衡,CO的平均反应速率v(CO)= ,该反应的平衡常数K= 。
(3)恒容条件下,达到平衡后,下列措施中能使n(CH3OH)/n(CO)增大的有 。
A.升高温度B.充入He气
C.再充入1molCO和3molH2 D.使用催化剂
(4)若在一体积可变的密闭容器中充入1molCO、2molH2和1molCH3OH,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(此过程三种物质均处于气态),则平衡时混合气体的平均摩尔质量=_____g/mol。
(5)根据(图2),写出此反应的热化学方程式 。
(Ⅰ)地壳中含量第一的金属元素构成的单质A与化合物B(分子量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B。则
(1)写出构成金属单质A的元素在周期表中的位置为 。
(2)写出D与水蒸气反应的化学方程式 。
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
(3)物质X的化学式为___________。“碱溶”时反应的离子方程式为_____________。
(4)为加快“酸浸”时的速率,可采取的措施有 、 等。(填两种即可)
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是______________。
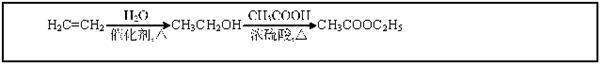
选修:有机化学基础】(芳香族化合物A 可进行如下转化:
回答下列问题:
(1)B 的化学名称为 。
(2)由C 合成涤纶的化学方程式为 。
(3)F 的苯环上一氯代物仅有两种,F 的结构简式为 。
(4)写出A 所有可能的结构简式 。
(5)符合下列条件的F 的同分异构体有 种。
①核磁共振氢谱显示苯环上有2 组峰;
②可发生银镜反应;
③使FeCl3溶液显紫色;
(6)D 有多种合成方法,在方框中写出由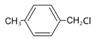 合成D 的路线流程图(其他原料任选)合成路线流程图示例如下:
合成D 的路线流程图(其他原料任选)合成路线流程图示例如下: