研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO |
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
实验室常用浓硫酸和乙醇混合加
 热制取乙烯。
热制取乙烯。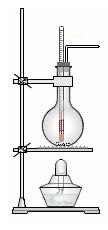
(1) 实验室制乙烯的化学方程式为。
(2)实验室用浓硫酸和乙醇混合加热制乙烯可用如上图所示装置,下列说法正确的是。
A.浓硫酸只作催化剂
B.在反应容器中放入几片碎瓷片防止混合液暴沸
C.反应温度缓慢上升至170℃
D.用排水法或向下排气法收集乙烯
E.园底烧瓶中装得是4mL乙醇和12mL3mol/L H2SO4混合液
F.温度计应 插入反应溶液液面下,以便控制温度
插入反应溶液液面下,以便控制温度
G.反应完毕后先熄灭酒精灯,再从水中取出导管
(3)若将此装置中的温度计换成分液漏斗,则还可以制取的气体有(酒精灯 可用可不用)。
可用可不用)。
A.CO2B.NH3C.O2 D.SO2E.NO2F.Cl2
(4) 如温度过高,反应后溶液颜色变。某同学设计下列实验以确定上述混合气体中含有乙烯和SO2。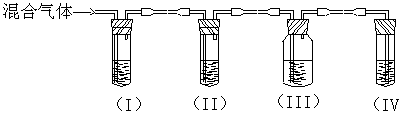
①I、II、III、IV装置可盛放的试剂是(请将下列有关试剂的序号填入空格内):
A、品红 B、NaOH溶液 C、浓硫酸D、酸性KMnO4溶液
I ;II;III;IV。
;II;III;IV。
②能说明SO2气体存在的现象是
③使用装置II的目的是;
④使用置III的目的是 ;
⑤确定含有乙烯的现象是。
某烃中碳、氢元素的质量比是24:5,该烃在标况下的密度是2.59g/L,则该烃的最简式是,摩尔质量是,分子式为。
某链烃的化学式为C6H4, 若分子中已有一个碳碳双键,则还含有碳碳叁键 个,某链烃的化学式为C200H200,则分子中最多含碳碳叁键个。
在有机物:①CH3CH3、 ②CH2=CH2、 ③CH3CH2C≡CH、
④CH3C≡CCH3、 ⑤C2H6、 ⑥CH3CH=CH2中,一定互为同系物的是,一定互为同分异构体的是。(填编号)
根据下列转化关系:
若D的密度为1.25克/升(标况),试推断A→E的结构简式。 
| A.___________ | B.___________ | C.___________ |
| D.___________ E.___________ |