某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HC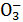 、OH-、N
、OH-、N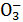 ,已知该溶液能与铝反应放出氢气。试回答下列问题:
,已知该溶液能与铝反应放出氢气。试回答下列问题:
(1)若反应后生成Al3+,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
(2)若反应后生成Al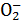 ,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。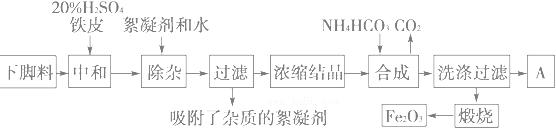
已知煅烧中的化学反应方程式为:FeCO3===FeO+CO2↑,4FeO+O2==2Fe2O3
(1)浓缩结晶后得到的晶体是________(填化学式),A中溶质是________;此溶液中各离子的浓度大小顺序为:________。
(2)20% H2SO4和铁皮的作用分别是_________。
(3)写出步骤“合成”中发生的化学变化(用化学方程式表示):_______________________。
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)X在周期表中的位置是_____________________________。
(2)化合物Y2X2的电子式为;它含有的化学键类型有(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为__________________________________________________________________。
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为___________________
(5)写出化合物Y2X2与水反应的离子方程式________________________________________。
(6)B的最高价氧化物的结构式为_______________________________________________。
下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为_______________。
(2)表中能形成两性氢氧化物的元素是______(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式__________________________________________________。
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为______________________________________(用化学式表示)。
(4)③元素与⑩元素两者核电荷数之差是__________。
(5)请写出②的氢化物发生催化氧化的化学方程式________________。
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式。
烷烃A在同温同压下蒸气的密度是H2的50倍的烷烃分子式,甲烷的电子式,二氯甲烷的结构式, 写出CH3(CH2)5CH3 的名称:。戊烷三种同分异构体的结构简式:____________________________________________________________________________________________________________________。
(1) 化学对人体健康有着十分重要的作用。
①为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。加碘食盐中碘的存在形式主要是_______。
②某同学到了傍晚时就看不见东西,患了夜盲症,可能的原因之一是他体内缺乏_________,另一同学在刷牙时牙龈经常出血,他可能缺乏_____________。
③某校食堂中餐食谱如下:
主食:大米饭配菜:红烧排骨煎鸡蛋炸鸡腿豆腐汤炒猪肝
主食和配菜中主要含维生素、__________、_________、__________、无机盐和水等营养素,考虑到各种营养成分的均衡搭配,应该增加含VC的配菜是_____________。
(2)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
①生活中的玻璃、陶瓷、水泥属于上述材料中的,其生产原料不需要使用石灰石的是。塑料制品给人类生活带来很多方便,但塑料制品造成的“白色污染”已成为社会一大公害,请你提出一项防治“白色污染”的有效措施。
②金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的,发生电化学腐蚀。
(3)2010年第41届世博会在上海成功举办,其主题是“城市,让生活更美好”。低碳经济是以低能耗、低污染、低排放为基础的经济模式,上海世博会的亮点之一是实现“二氧化碳零排放”。
①世博停车场,安装有汽车尾气催化光解设施,它能将汽车尾气中CO和NOx反应生成可参与大气生态环境循环的无毒气体,写出CO和NO在一定条件下反应的化学方程式。
②合理利用二氧化碳,可以提高生活质量,促进工业发展。在常压下,-78℃时,二氧化碳气体凝结成固态二氧化碳,俗称干冰。某学生买回一盒冰淇淋月饼,盒里有很多作为致冷剂的碎干冰。下列关于干冰处理的正确做法是()
| A.将干冰放入冰箱 | B.让干冰在通风处自然升华 |
| C.直接将干冰倒入下水道 | D.用手取干冰扔入废物箱 |
③现在人们使用乙醇汽油作为汽车燃料充分体现了低碳经济,物质的量相同的乙醇与汽油(设为C8H18)均完全燃烧产生的CO2的物质的量之比为。