用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落。下列关于上述实验中有关问题的解释不正确的是 ( )
| A.铝在空气中能很快形成氧化膜 |
| B.铝箔失去金属光泽,氧化铝包裹着金属铝 |
| C.氧化铝的熔点比铝高 |
| D.氧化铝与盐酸不反应 |
下列叙述正确的是
A. 具有还原性,故可作漂白剂 具有还原性,故可作漂白剂 |
B.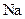 的金属活性比 的金属活性比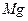 强,故可用 强,故可用 与 与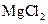 溶液反应制 溶液反应制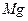 |
C.浓硝酸中的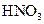 见光分解,故有时在实验室看到的浓硝酸呈黄色 见光分解,故有时在实验室看到的浓硝酸呈黄色 |
D.F e在 e在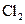 中燃烧生成 中燃烧生成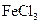 ,故在与其他非金属反应的产物中的Fe也显+3价 ,故在与其他非金属反应的产物中的Fe也显+3价 |
有三个氧化还原反应:①2FeCl3+2KI===2FeCl2+I2+2KCl
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
| A.Cl2 | B.KMnO4 | C.FeCl3 | D.HCl |
复杂的体系中,研究化学反应的先后顺序有利于解决问题。下列物质或微粒参与反应先后顺序判断正确的是
A.含有等物质的量的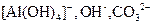 的溶液中逐滴加入盐酸: 的溶液中逐滴加入盐酸: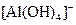 , ,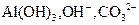 |
| B.含有等物质的量的FeBr2和Fel2溶液中缓缓通入Cl2:I-, Br-, Fe2+ |
| C.在等物质的量的K2CO3和KOH混合溶液中缓缓通入CO2:K2CO3,KOH |
D.在含有等物质的量的 , ,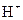 的溶液中逐渐加入锌粉: 的溶液中逐渐加入锌粉: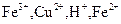 |
钠和碳分别置于下图所示的两个盛满氧气的集气瓶中燃烧完毕冷却至室温后,打开装置中的两 个活塞,这时观察到
个活塞,这时观察到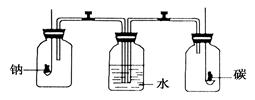
| A.水进入左瓶 | B.水进入右瓶 | C.水同时进入两瓶 | D.水不进入任何一瓶 |
是某学校实验室从化学试剂商店买回的硫酸试剂标签上的内容。据此,下列说法正确的是
| A.该硫酸的物质的量浓度为9.2mol/L |
| B.1molZn与足量的该硫酸反应产生2克H2 |
| C.配制200ml 4.6mol/L的稀硫酸需要取该硫酸50ml |
| D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |