资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。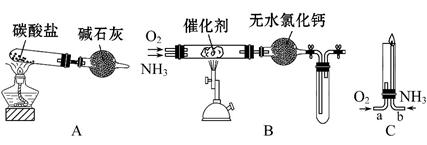
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热。氨催化氧化的化学方程式是 ;
试管内气体变为红棕色,该反应的化学方程式是
。
(3)将过量的氧气与A产生的氨气分别由a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 ,
其理由是 。
②氨气燃烧的化学方程式是 。
硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80 ℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请完成下列问题:
(1)实验步骤①的目的是___________________,加热的作用是
_________________________。
(2)实验步骤②明显不合理,理由是
________________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_________________;
__________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
| 温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
| 溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
| 析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
如图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。适合下列各种情况的分别填入该题后(填图的字母代码)。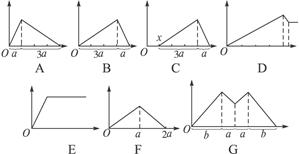
(1)向石灰水中通入二氧化碳_________。
(2)向氯化铝溶液中滴入NaOH溶液_________。
(3)向偏铝酸钠溶液中加入稀盐酸_________。
(4)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液_________。
(5)向MgCl2和AlCl3混合液中加入过量的NaOH溶液_________。
(6)向MgCl2和AlCl3混合液中先加NaOH溶液后,至沉淀不再溶解,加HCl溶液_________。
(7)向AlCl3溶液中加氨水_________。
(8)向NaAlO2溶液中通入CO2气体_________。
(9)向KAl(SO4)2中滴加Ba(OH)2_________。
(10)向Al2(SO4)3中滴加NaAlO2溶液_________。
木炭与浓硫酸在加热条件下发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O↑,下图虚线框中的装置可用来检验该反应产生的所有气体产物,请完成下列问题:
CO2↑+2SO2↑+2H2O↑,下图虚线框中的装置可用来检验该反应产生的所有气体产物,请完成下列问题:
(1)如果装置中①②③三部分仪器的连接顺序改变②①③,则可以检出的物质是___________;不能检出的物质是___________。
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是___________;不能检出的物质是___________。
(3)如果将仪器的连接顺序变为②③①,则可以检出的物质是___________;不能检出的物质是___________。
有两种盐A和B,A是白色固体,B是黑色固体,它们都跟稀H2SO4反应,其中物质A与稀H2SO4反应生成气体C,物质B与稀H2SO4反应生成气体D。气体C和气体D混合后产生淡黄色固体E。把气体C通入足量的NaOH溶液中生成物质A。物质E跟铁在加热条件下反应生成物质B。试完成下列问题:
(1)用化学式表示:A___________,B___________,C___________, D___________。
(2)完成下列反应的化学方程式:
①物质A和稀H2SO4反应:_____________________________________________________。
②物质B和稀H2SO4反应:_____________________________________________________。
③气体C和气体D反应:_______________________________________________________。
④气体C和NaOH溶液反应:_____________________________________________________。
⑤物质E和铁反应:____________________________________________________________。
有6瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠,现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请完成下列问题:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管,观察到的现象是__________________________________,被检出的物质的化学式(分子式)是_____________。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象是1支试管中有白色沉淀生成,写出相应反应的离子方程式(下同):____________________,2支试管中有蓝色沉淀生成:_______________________,被检出的物质的化学式(分子式)是_____________。
(3)鉴别余下未检出物质的方法和观察到的现象是___________________________________。