(9)为了将混有硫酸钠的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:
(1)操作①能否用硝酸钡溶液?_____ (能或否)说明理由__________________。
(2)进行操作①后,如何判断SO42-已除尽,方法是_____________ ________________。
(3)操作②的目的是_______________,为什么不先过滤而后加碳酸钠溶液,其理由 是______________。
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如右的坐标曲线来表示,回答下列问题: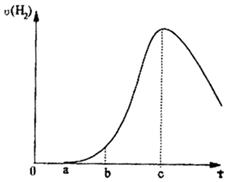
曲线由0→a段不产生氢气的原因____________________,
有关的离子方程式为___________________________;曲线由a→b段产生氢气的速率较慢的原因________________;
曲线由b→c段,产生氢气的速率增加较快的主要原因___________;
曲线由c以后,产生氢气的速率逐渐下降的主要原因____________。
根据提供条件推断元素,并按要求填空:原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式 ________ ,最高价氧化物对应水化物化学式 ________ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为 ___________________________。
第3周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为______________,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为 _______________。
原子序数依次递增的同周期四种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为 _______、 ________、 ________、 ________ 。
某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素最高价氧化物的化学式为 ________ 。
当一个化学反应中反应物总能量大于生成物总能量时,此反应为_______反应(吸热或放热),酸碱中和是____________反应(吸热或放热)。
氯原子的质量数为37,中子数为20,那么它的核外电子数是__________,质子数是__________。
具有相同 和不同 的同一种元素的原子互称为同位素。