粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)如何运用最简方法检验溶液中有无SO42—?_________。如果有,应该如何除去SO42—? _____________
(2)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_____________________________________。
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质? ________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:_____________________; 过滤时:_________________; 蒸发时:____________。
某兴趣小组采用如下方法制作氢氧燃料电池。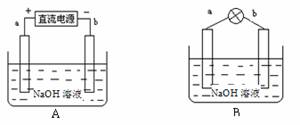
(1)如图A所示:a、b均为多孔石墨棒(多孔石墨棒,可吸附并储存生成的气体),其中a与直流电源正极相连,b与直流电源负极相连,电解质溶液为NaOH溶液,则a电极上发生的电极反应式为_________________,电解后溶液的pH____________(填“增大”、“减小”或“不变”)。
(2)然后如图B所示,移走直流电源,在a、b极间连接一个发光二极管,可以看到二极管发光。此时的电流方向是______________(填“a→b”或“b→a”),b极的电极反应式为______________________________ _。
(3)假设a极吸收22.4L(标准状况)气体,能量转化率为60%,则通过二极管的电子的物质的量为______________。
氢氧燃料电池是最常见的燃料电池,该电池在正极通入氧气,在负极通入氢气,而电解质溶液通常是KOH溶液。
(1)请写出氢氧燃料电池的正极反应方程式。
(2)氢氧燃料电池有何优点?
已知下列热化学方程式:Zn(s) + 1/2O2(g) = ZnO(s)△H=" -" 351.1kJ/mol
Hg(l) + 1/2O2(g) = HgO(s)△H=" -" 90.7kJ/mol
由此可知反应 Zn(s) + HgO(s) =" ZnO(s)" + Hg(l) 的焓变为
对羟基甲苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1:1。
回答下列问题:
(1)A的化学名称为;
(2)由B生成C的化学方程式为,该反应类型为_;
(3)D的结构简式为;
(4)F的分子式为;
(5)G的结构简式为;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有种,其中核磁共振氢谱三种不同化学环境的氢,且峰面积比为2:2:1的是(写结构简式)。
在下列物质中是同系物的有;互为同分异构体的有;互为同素异形体的有;互为同位素的有;互为同一物质的有;
(1)液氯(2)氯气 (3)白磷 (4)红磷(5)氕 (6)氚
(7) 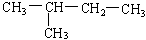 (8)
(8) 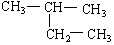
(9)CH2 = CH-CH3(10) 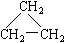 (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷