(本题共14分)
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(1),氨水]吸收在生产过程中产生的CO和CO2等气体,铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac(Ac表示醋酸根)
[Cu(NH3)3CO]Ac(Ac表示醋酸根)
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a. 减压 b. 增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式:
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
.
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为
通过比较 可判断氮、磷两种元素的非金属性强弱。
(5)已知CS2和CO2分子结构相似,CS2的电子式是
CS2熔点高于CO2,其原因是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是________,且各离子的物质的量之比为_______;肯定不含的阳离子是_______________,判断的理由是。
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答: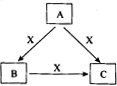
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为___________。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为____________________________________________________________。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构。
①B的电子式为_____________。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为_______________________。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是_____________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为_______________________________________。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________。
(14分)已知在 25℃时,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH)/c(H+)________(填“增大”、“减小”或“不变”)。
(6分)(1)FeCl3水溶液呈性,原因是(用离子方程式表示)。
为了防止发生水解,可以加入少量的。
(2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)除去MgCl2溶液中的少量FeCl3杂质可选择的合理试剂是。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)25℃时,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),①和两种粒子的物质的量之和等于0.1mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小顺序关系中正确的是(选填序号)。
②若上述关系中C是正确的,则溶液中溶质的化学式是。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c (HCl)(填“>”、“<”、或“=”,下同)c(NH3·H2O).
混合后溶液中与c(NH4+)c(Cl-)。