下图烧杯中都盛有稀硫酸,则:
(1)A中进行的离子反应方程式为 。
(2)B中负极反应式: ;溶液的pH___________(填入增大、减小或不变)。
(3)C中被腐蚀的金属是 ,正极反应式为 。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是 。
(5)某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。回答下列问题: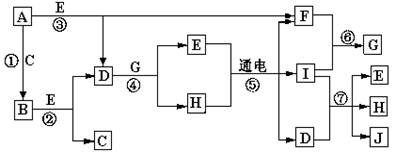
(1)B中的化学键有,(填“离子键”、“极性键”或“非极性键”) E的电子式。
(2)写出反应⑦的离子方程式__________________________
(3)向AlCl3溶液中加入少量固体B,写出反应的化学方程式_____________________
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)
极附近溶液由无色变为红色,其原因是
2011年6月20日我国卫生部正式实施了GB2760-2011《食品安全国家标准食品添加剂使用标准》,对部分食品添加剂的使用规定进行了调整。食品添加剂F1和F2的制备流程分别如下(部分反应条件略)。
(一)F1的制备流程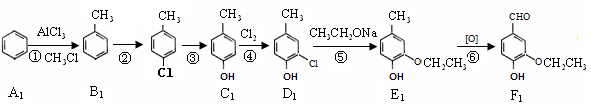
(1)、属于氧化反应的有_______(填写反应序号)。反应②的化学反应方程式是:。
(2)、B1中有少量A1,分离的方法是:。
(3)、F1在适当的氧化剂作用下,得到产物C9H10O4,酸性增强,该产物在一定条件下发生聚合反应,聚合产物的结构简式为_______________________。
(二)F2的制备流程
已知:①烃A2常作为切割金属的燃料。
②同一碳原子上有两个羟基的化合物不稳定,易脱水生成醛或酮: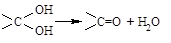
③醛 与醛
与醛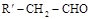 在一定条件下反应,可得到
在一定条件下反应,可得到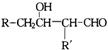
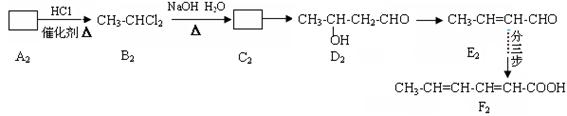
(4)、写出C2结构简式: ___________;B 2的同分异构体的名称:__________。
(5)、与D2互为同分异构体、分子中含两个甲基的酯共有_______种。
(6)、E2→F2的三步反应中的前两步反应与C2→D2→E2的反应过程相似。完成E2→F2第二步反应的化学方程式: 。
2-甲基丙烯是制备有机玻璃的主要原料。现以2-甲基丙烯为原料,通过下列合成路线合成有机玻璃F。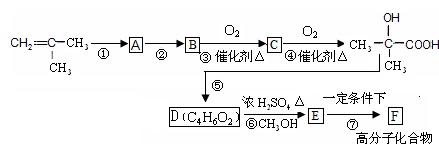
根据上述过程回答下列问题:
(1)、填写反应类型:反应⑦是,反应⑤是。
(2)、写出结构简式:BF。
(3)、写出物质D中所含官能团的名称:。
(4)、写出反应③的化学方程式。
在一个体积为2L的密闭容器中,高温下发生下列反应:
Fe(s) + CO2(g) FeO(s) + CO(g) + Q kJ
FeO(s) + CO(g) + Q kJ
其中CO2、CO的物质的量(mol)随时间(min)的变化如图所示。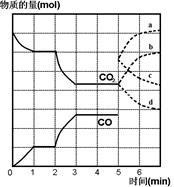
(1)、反应在1min时第一次达到平衡状态,固体的质量增加了3.2g。用CO的浓度变化表示的反应速率υ(CO)=_________。
(2)、反应进行至2min时,若只改变一个条件,曲线发生的变化如图所示,3min时再次达到平衡,则Q0(填“>”、“<”或“=”)。第一次平衡与第二次平衡的平衡常数相比,K1K2。(填“>”、“<”或“=”)。
(3)、5min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是(填写编号)。
a.υ(正)先增大后减小 b.υ(正)先减小后增大
c.υ(逆)先增大后减小 d.υ(逆)先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)、请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:
______________________________________________________________________。
多硫化钠(Na2SX)在制革工业中常用作皮毛的脱毛剂,农业上可作杀虫剂,也是分析化学中的常用试剂。在碱性溶液中,Na2SX与NaBrO3发生反应生成Na2SO4与NaBr。
(1)、上述反应中发生氧化反应的物质是,被还原的元素是(填写元素符号或化学式)。
(2)、若Na2SX与NaBrO3反应的物质的量之比为3:10,则x = 。
(3)、NaBrO3也可以在酸性条件下与NaBr反应生成Br2。若生成6mol Br2,则反应中转移电子的物质的量为。
(4)、根据上述两个反应,可推知Na2SX、 Br2、NaBr还原性由强到弱的顺序是(填写化学式)。