在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2 min的平均速率ν(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
能正确表示下列反应的离子方程式是()
| A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+ |
| B.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++2H2O+NO↑ |
| C.醋酸溶液与纯碱反应:CO32-+2H+=+H2O+CO2↑ |
| D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K="220" 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ()
()
A.CO与HbO2反应的平衡常数K=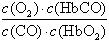 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是()
A.2H+(aq) + (aq)+ (aq)+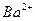 (aq)+2OH (aq)+2OH (aq)=BaSO4(s)+2H (aq)=BaSO4(s)+2H O(1); O(1); H= H=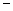 57.3 kJ/mol 57.3 kJ/mol |
B.KOH(aq)+ H2 SO4(aq)= H2 SO4(aq)=  K2SO4(aq)+H K2SO4(aq)+H O(I); O(I); H= H=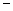 57.3kJ/mol 57.3kJ/mol |
C.C8H18(I)+ 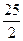 O2(g)=8CO O2(g)=8CO (g)+ 9H2O; (g)+ 9H2O; H= H=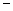 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1); H= H= 5518 kJ/mol 5518 kJ/mol |
物质的量浓度相同的下列溶液,pH由大到小排列正确的是()
| A.Ba(OH)2、 Na2SO3、FeCl3、KCl |
| B.Na2SiO3、Na2SO3、KNO3、NH4Cl |
| C.NH3·H2O、H3PO4、Na2SO4、H2SO4 |
| D.NaHCO3、C6H5COOH、C2H5OH、HCl |
下列说法正确的是()
| A.增大压强,活化分子数增加,化学反应速率一定增大 |
| B.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| C.活化分子间所发生的分子间的碰撞为有效碰撞 |
| D.加入反应物,使活化分子百分数增加,化学反应速率增大 |