(10分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
| A.Cl2、Br2、I2的熔点 | B. Cl2、Br2、I2的氧化性 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液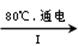 NaClO3溶液
NaClO3溶液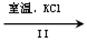 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。 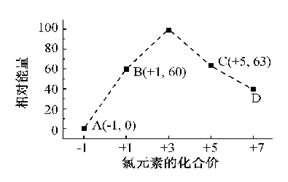
①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
(1)根据NaH的存在,有人提议可把氢元素放在族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的族。
(2)现有甲、乙两种元素,甲元素在第三周期第VIIA族,甲元素与碘元素相比较,非金属性较强的是(填元素名称),写出可以验证该结论的一个化学反应方程式
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。甲、乙两元素相比较,金属性较强的是(填名称),可以验证该结论的实验是()。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
X、Y、Z、W是中学化学中常见的四种气体。已知:X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收;X是化石燃料燃烧的产物之一,是形成酸雨的物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业的汽车尾气中的有害物质之一,能与水反应;W气体的水溶液滴入酚酞变红色。
请回答下列问题:
(1)X、Y两种气体按物质的量之比1:1在水溶液中能发生反应,化学方程式为;
(2)科学家发现,Z在催化剂条件下能与W反应生成无毒物质,化学方程式为;其中的氧化剂是(填化学式)。
(3)在Z与水的反应中,氧化剂与还原剂的物质的量之比为。
(4)检验W气体的方法是。
(1)写出下列物质在水溶液中的电离方程式
氯化铜
硫酸铁
(2)写出下列反应的离子方程式
硫酸溶液与氢氧化钡溶液混合
碳酸氢钠溶液与稀盐酸混合
① 0.4mol NaCl的质量为g,64g氧气的含氧原子数目为。
②在标准状况下,44.8L NH3的物质的量为,与克H2S的物质的量相等。
③1.5mol SO2与 g SO3含有相同质量的氧元素。等质量的CO与CO2含氧元素质量比为。
可以通过现象来区别溶液和胶体。能使胶 体聚沉的方法(只需写出其中一种):。