(共14分)(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表: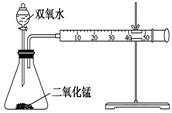
 MnO2 MnO2时间 H2O2 |
0.1 g |
0.3 g |
0.8 g |
| 10 mL 1.5% |
223 s |
67 s |
56 s |
| 10 mL 3.0% |
308 s |
109 s |
98 s |
| 10 mL 4.5% |
395 s |
149 s |
116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入___g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确___,理由是__________。(提示:H2O2的密度可认为近似相等)。
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似为1g·mL-1。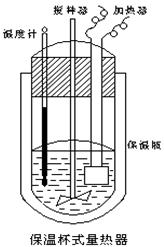
(1)试求CH3COOH的中和热△H=________________。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因________________。
(3)实验中NaOH过量的目的是________________。
如图是实验室干馏煤的装置图,回答下列问题:
(1)反应完毕后,试管A中剩下的灰黑色固体是______________________;
试管B中液体分两层,上层为澄清、透明的水溶液,能使酚酞变红是________,下层的黑色黏稠物是______________________________,
写出其中的成分与HNO3反应的化学方程式(2个)______________________,______________________。
(2)C处点燃的气体在工业上叫________,其主要成分是________。
(14分)某合成氨厂利用附近化工厂副产品CaSO4设计了以下制备(NH4)2SO4的工艺流程:
请回答以下问题:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)工业上在500℃左右使用铁触媒作为催化剂合成NH3,
①铁触媒中含有Fe3+,,则Fe3+的核外电子排布式为
②500℃时,合成塔中的反应为:N2(g)+3H2(g)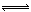 2NH3(g)∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是(填字母编号)。
2NH3(g)∆H= -92.4kJ/mol在密闭条件下,下列示意图能说明反应进行到t1时刻时达到平衡状态的是(填字母编号)。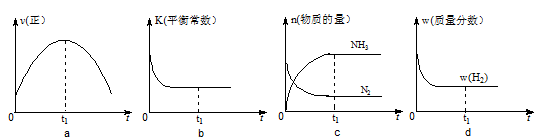
(3)沉淀池中反应的化学方程式为
(4)在上述流程中可以循环使用的X是(填化学式),从(NH4)2SO4溶液中获得 (NH4)2SO4晶体操作的步骤是是加热浓缩、、过滤、洗涤、干燥。
(6分)溶液配制是中学化学实验的基本操作。
(1)用氢氧化钠固体配制100g10%的氢氧化钠溶液时,需要用到的玻璃仪器有玻璃棒和 __________。
(2)配制一定物质的量浓度溶液时用到的仪器较多,下列有关叙述正确的是_____。
a.称量NaOH固体时,分别在天平的两个托盘垫上相同大小的纸片
b.玻璃棒的作用是搅拌、引流
c.用浓硫酸配制稀溶液时,在量筒中稀释后要冷却至室温再转移到容量瓶中
d.容量瓶在使用前要检查是否漏水
(3)实验室配制一定物质的量浓度溶液,试叙述定容操作的具体方法:向容量瓶中注入蒸馏水至离刻度线1~2cm处,然后________________________________。
某兴趣小组利用以下装置制备氮化镁并探究氮化镁的某些性质。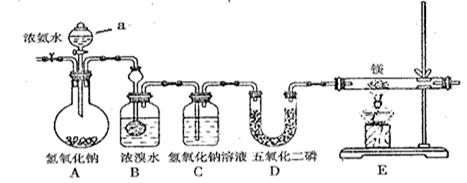
请完成横线上的相关问题:
(1)实验步骤及现象:
① 连接仪器并。然后,向各仪器中加入适量所需药品。② 。
③ 打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡。
④ 点燃酒精灯,观察到E中固体变成了黄绿色。(氮化镁是黄绿色固体,遇水剧烈反应生成两种碱)
(2)A装置中仪器a的名称为。
(3)写出B处反应的化学方程式。
(4)D装置中P2O5是一种非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是。
| A.NH3 | B.H2 | C.SO2 | D.CO2 |
(5)E装置中发生反应的化学方程式为。
(6)此装置中存在着明显缺陷,你的改进措施是。
(7)某同学要探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式、。
下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: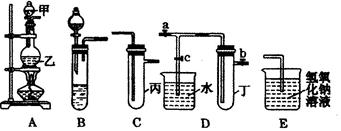
(1)将A、C、E相连后,以浓盐酸和(填写名称)为原料制取Cl2,仪器乙的名称是。
写出实验中制备氯气的离子方程式。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验 序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将所得氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
向所得氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):。
实验Ⅱ获得结论是否合理?(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先,再以使烧杯中的水进入试管丁,观察现象。