由稀有气体元素Xe(氙)形成的一种共价化合物XeO3极不稳定,易转化为单质而呈强氧化性。将适量的XeO3投入30 mL Mn2+浓度为0.1 mol·L-1的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56 mL,在反应过程中溶液的pH不断减小。
(1)已知Mn2+在不同条件下,可被氧化为+4、+6、+7等不同价态,依据题目所给出的数据推算氧化产物中锰元素的化合价为____________。
(2)试写出有关的离子方程式:________________。
(3)若将反应后的溶液稀释至90 mL,则稀释后溶液的pH为____________。
为了探究硫酸铜对硫酸与锌反应速率的影响,有同学设计了在一定条件下进行如下实验,测量在不同试剂用量的反应条件下获得相同量气体所用的时间。
(1)请完成下表(填写表格中的空白处)(假设溶液混合时体积变化忽略不计)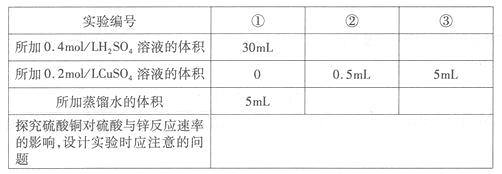
(2)实验③一段时间后可看到的锌粒表面呈色。
(3)实验表明②号实验最快,③号实验最慢,可能的原因是
2011年8月云南报道铬渣污染事件,铬渣中到含璃+6价的铬而使其毒性强利用钛铁矿(TiO2、FeO、Fe2O3)生产钛白粉的副产品(硫酸亚铁),可以把其还原为+3价的铬,在碱性条什生成氢氧化铬沉淀。
(1)碾碎的目的是
(2)加入过量的硫酸除让铁矿充分反应外,还起到的作用是 [来
(3)第④步所加试剂是
(4)上述物质中可循环使用的试剂是(写化学式)
(5)写出滤液④与Na2CrO4在NaOH溶液中反应的离子反应方程式
(6)第③步中加热的目的是
有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香渡的芳香赋予剂。
已知:
①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有(选填序号)。
①取代反应②消去反应③加聚反应④氧化反应
(2)D、F分子所含的官能团的名称依次是、。
(3)写出与D、E具有相同官能团的两种同分异构体的结构简式、。
(4)请写出B+E→A的化学反应方程式。
(5)某学生检验C的官能团时,取1mol/LCuSO4溶液和2mol/LNaOH溶液各lmL,在一支洁净的试管内混合后,向其中又加入0.5 mL 40%的C,加热后无红色沉淀出现。该同学实验失败的原因可能是。(选填序号)
①加入的C过多②加入的C太少
③加入CuSO4溶液的量过多④加入CuSO4溶液的量不够
磷有三种同素异形体,分别为白磷(P4)、红磷和黑磷。
(1)白磷常温为白色或淡黄色固体,在40℃左右自燃,实验室保存少量白磷的方法是。
(2)白磷 黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是填选项字母)
黑磷,黑磷比白磷稳定.结构与石墨相似,下列叙述正确的是填选项字母)
A.黑磷与白磷互为同分异构体 B.黑磷能导电
C.白磷转化为黑磷为氧化还原反应 D.白磷转化为黑磷为放热反应
(3)红磷在氯气中燃烧生成两种氯化物,其中一种氯化物分子是每个原子最外层都满足8个电子的结构,则该氯化物的空间构型与下列分子最相似(填选项字母)
A.H2O B.CCl4C.NH3D.CS2
(4)已知白磷、红磷燃烧的热化学方程式分别为
①P4(s、白磷)+5O2(g)=P4O10(s);△H=-986KJ·mol-1
②P(s、红磷)+ O2(g)=
O2(g)= P4O10(s);△H=-739KJ·mol-1
P4O10(s);△H=-739KJ·mol-1
写出红磷转化为白磷的热化学方程式。
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在。
(3)①C在一定条件下反应生成A的化学方程式是。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH<7,其原因是(写出离子方程式)。