碳是形成化合物种类最多的元素。
(1)CH2=CH-C≡N是制备腈纶的原料,其分子中 键和
键和 键的个数之比为__________(填最简整数比);
键的个数之比为__________(填最简整数比);
(2)乙醇CH3CH2OH与甲醚CH3OCH3的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是____________________;
(3)某元素位于第4周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为_______________.
我国是个农业大国,农业是立国之本,“农村、农业、农民”是党中央新时期农村工作的重心,化肥与农药的发展起着巨大的推动作用,请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有Fe、Mn、B、Cu、Mo等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质的形成和新陈代谢不可缺少的。常用铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液________(填“喷在叶片上”或“随水灌入土壤中”),主要理由是____________________________________________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为胆矾、生石灰、水,按质量比1∶0.56∶100混合,分析其防治病虫害的原因____________________________________。
(3)拟除虫菊酯是一种高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图。
其分子式为________,则下列对该化合物的叙述正确的是________。
A.该化合物属于芳香烃
B.该化合物属于卤代烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
请你参与识别化肥的探究活动,有五种化肥,分别是硫酸钾、氯化钾、碳酸氢铵、氯化铵和硝酸铵。
第一步:称取五种化肥各10 g,分别研细;
第二步:硝酸铵和熟石灰反应的化学方程式是:_____________________________________。
第三步:另取三种铵盐各少量,分盛于三支试管中,均滴入少量盐酸,无明显现象的是____________,有气泡放出的是________。反应的化学方程式:______________________________________________________________。
第四步:另取氯化铵和硝酸铵两种铵盐进行识别,写出识别时发生反应的化学方程式:_____________________________________________________________。
第五步:取两种钾盐,分别在试管中配成溶液,各滴入几滴氯化钡溶液,生成白色沉淀的钾盐是________,无明显现象的钾盐是________。
瑞士化学家米勒因合成DDT于1948年获得诺贝尔奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5 000万生命。”但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是为什么?________________________________________________________________。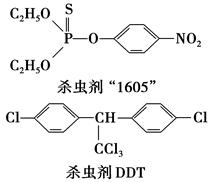
由结构分析知:“1605”在使用过程中,不能与________物质混合使用,否则会因________。
(2)DDT可以用电石为原料经以下途径而制得:
①写出④⑤⑥步反应的化学方程式。
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构简式如下)。在实验室也可实现这种转化,表示这种转化的化学方程式为____________________________________________________________。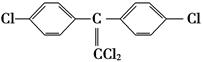
蚂蚁等群居性昆虫在找到食物后的归巢途中,用一种自身分泌物涂在地上,为其他蚂蚁觅食引路。这种分泌物叫跟踪剂,是信息素的一种。所谓信息素,是指同种生物个体间用来传递信息的化学物质。蚂蚁跟踪信息素叫牻牛儿醇(又叫香叶醇),可用作香料或昆虫引诱剂。对其组成分析结果为:含C:77.86%,H:11.76%,O:10.37%,相对分子质量为154。此信息素与臭氧反应,生成臭氧化物;再与水和Zn反应,发生水解,使分子中双键断裂,其规律

(1)通过计算写出此信息素的化学式为__________________________________________;
(2)此信息素的结构简式为_________________________________________________;
(3)此信息素的系统命名为________________________________________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。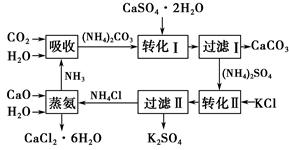
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:______________________________________________________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:_______________________________________________________________。
(5)已知不同温度下K2SO4在100 g水中达到饱和时溶解的量如下表:
| 温度/℃ |
0 |
20 |
60 |
| K2SO4溶解的量/g |
7.4 |
11.1 |
18.2 |
60 ℃时K2SO4的饱和溶液591 g冷却到0 ℃,可析出K2SO4晶体________g。
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是:________________________________________________________________。