(本题共10分)(一)中学常见单质A、B和甲、乙、丙三种化合物有如图所示的转换关系(部分产物未列出)。单质A常作为食品包装材料,甲是两性氧化物。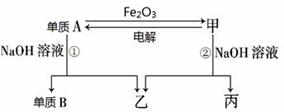
根据图示转化关系回答:
(1)写出下列物质的化学式:单质A_______________,乙_______________。
(2)写出单质A与Fe2O3反应的化学方程式: ,利用该反应的原理,可用于______________________________。
(3)用单质A做成的容器可以储存和运输浓硫酸的原因是____________________________。
(4)写出反应①的离子方程式:_____________________________________________。
(二)(5)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(6)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有( )
a.KCl b. KClO 3 c. MnO2 d. Mg
F是新型降压药替米沙坦的中间体,可由下列路线合成: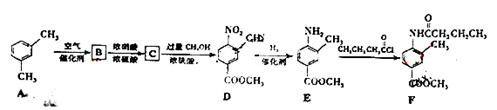
(1)A B的反应类型是,D
B的反应类型是,D E的反应类型是,E
E的反应类型是,E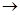 F的反应类型是。
F的反应类型是。
(2)写出满足下列条件的B的所有同分异构体(写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应
(3)C中含氧官能团名称是。已知固体C在加热条件下可溶于甲醇,下列C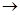 D的有关说法正确的是。
D的有关说法正确的是。
a.使用过量的甲醇,是为了提高D的产量 b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇即是反应物,又是溶剂 d.D的化学式为C9H9NO4
下表所列物质(括号内为少量杂质),在B中选择试剂,在C中选择操作的方法。填表(填入序号):
B:(1)NaCl细颗粒;(2)NaOH溶液;(3)水;(4)CaO;(5)饱和Na2CO3;(6)溴水;(7)KMnO4溶液。
C:(1)变性;(2)盐析;(3)蒸馏;(4)分液;(5)结晶;(6)洗气。
| 物质 |
加入试剂 |
操作方法 |
| ①苯(苯甲酸) |
||
| ②乙烷(乙烯) |
||
| ③肥皂(甘油) |
||
| ④乙醇(水) |
||
| ⑤乙酸乙酯(乙酸) |
已知:
① A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素X、Y、Z的原子序数依次递增。
② X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是,Z是(用元素名称填空)。
(2)写出③中反应的化学方程式:。
(3)写出④中反应的化学方程式:。
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18 g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
(1)烧瓶a中发生的是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速升高到170℃,否则容易发生副反应。请写出乙醇发生消去反应的方程式。
(2)写出制备1,2-二溴乙烷的化学方程式:。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请回答发生堵塞时瓶b中的现象:。
(4)容器c中NaOH溶液的作用是:。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_______________。
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是。