(本题共10分)(NH4)2Fe(SO4)2·6H2O俗名摩尔盐,价格便宜,可用来净水或治疗缺铁性贫血等,是一种重要的化工原料。
(1)摩尔盐的水溶液呈 色。
(2)c(Fe2+)相同的摩尔盐和硫酸亚铁两溶液比较,物质的量浓度较大的是 。
(3)甲乙两位同学想测定一瓶摩尔盐的纯度。甲同学设计的实验装置如下图: 。
。
从上图推断甲同学想通过测定 计算摩尔盐的纯度。该方案的不足之处在于 。
(4)乙同学在甲同学的基础上做了改进,其实验装置如下图: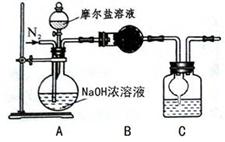 。
。
则B与C中的试剂分别是 和 。C中干燥管的作用是 。乙同学称取了 10.0g的摩尔盐样品,若实验完毕后测得洗气瓶及瓶内溶液共增重 0.68g,则依此数据推算这份摩尔盐的纯度为 %(答案精确到小数点后第一位)。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。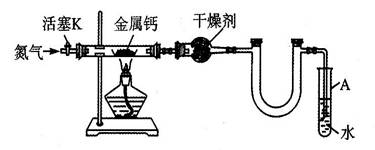
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
| 直玻管质量m0/g |
直玻管与钙的质量m1/g |
直玻管与产物的质量m2/g |
| 14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= 。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
用KOH固体配制质量分数为28%的KOH溶液(ρ=1.1g/mL)。
(1)溶液中OH-与H2O分子个数之比为 ,溶液的物质的量浓度为 。
(2)若需配制上述溶液95mL,则需称量KOH固体 克,需用到的玻璃仪器有: 。
(3)容量瓶使用前检漏的操作为: 。
(4)下列操作中,使所得KOH溶液浓度偏大的是 。
| A.称量KOH固体时,直接用纸称量; |
| B.KOH固体溶解后,未完全冷却就转移至容量瓶中; |
| C.定容时,俯视容量瓶标线; |
| D.配制溶液前,容量瓶未完全干燥; |
E、转移溶液时,有少量液体溅出
.在实验室中用二氧化锰跟浓盐酸反应制备干燥且较纯净的氯气。进行此实验,所用仪器如下图:
(1)连接上述仪器的正确顺序是(填各接口处的字母):
接,_____接,_____接,接。
(2)在装置中:
①饱和食盐水的作用是,
②浓硫酸的作用是。
(3)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:;
②尾气吸收装置中进行的反应:。
(4)MnO2是______色的粉末状固体,在该实验中MnO2所起得作用是____________
(5)若实验操作正确,在集气瓶内若放一块干燥的有色布条,在实验进行的过程中,有色布条能否褪色?(填“能”或“不能”)________.
用氯化钠固体配制1.00mol/L的NaCl溶液500mL,回答下列问题
(1)请写出该实验的实验步骤
①计算,②称量,③,④冷却,⑤移液,⑥洗涤并移液,⑦,⑧摇匀。
(2)所需仪器为:500mL容量瓶、托盘天平、玻璃棒、烧杯,还必需一个仪器,该仪器的名称是:。使用容量瓶前必须进行的操作是。用托盘天平称取氯化钠固体的质量是________g
(3)试分析下列操作对所配溶液的浓度有何影响。(填“偏高”或“偏低”或“无影响”)
①容量瓶没有干燥,有少量的蒸馏水:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度:。
③定容是俯视刻度线:。
NaCl中混有少量的硝酸钾,要除去硝酸钾,所用的方法是___________________,汽油和水的混合物分离的方法是____________