(10分)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) ="=" 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ="=" C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) ="=" 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 (填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量 (填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要 (填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是 。
(3)b 与a、c、d的数学关系式是 。
如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生 。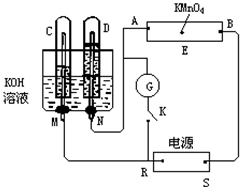
(1)外电源的正、负极分别是R为____,S为_____。
(2)A附近溶液的现象是_______,B附近发生的电极反应式为。
(3)滤纸上的紫色点向哪方移动(填A或B)。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为, 有关的电极反应式为。
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是(填编号);
(2)表中编号原子中,半径最小的是(填元素符号,下同),第一电离能最小的是:,电负性最大的是;
电负性大小:⑤元素④元素(填大于、等于或小于),第一电离能大小:⑤元素④元素( 填大于、等于或小于)。
(3)某元素的价电子排布式为nsn-1npn+1,该元素原子的最外电子层的孤对电子数为;该元素还可与元素①形成18电子的气体分子Y,将过量的Y气体通入盛有硫酸铜水溶液的试管里,反应的离子方程式为:;
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据:

表中的金属元素是(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
A、B、C、D、E、F为原子序数依次增大的六种元素。已知:A是周期表中原
子半径最小的元素.B的基态原子核外电子有 7种运动状态,B、C、E三种元素原子中未
成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化
合物,F原子核外最外层只有1个电子,其余各层均充满电子。
回答下列问题:
(1)写出下列元素的名称:BCE
(2)F在周期表位位于区,与F同周期且未成对电子数最多的元素为(填
写元素符号),该元素价电子排布图为;
(3)B与D组成的化合物可以与水反应,写出它与水反应的化学方程式
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列关于氮元素的有关问题。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ;⊿H=" -574" kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g);⊿H=" -1160" kJ·mol-1
③H2O(g) = H2O(l) ; △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式,该反应的熵变⊿S0(填“>”、“<”、“="”" )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
①10min~20min以V(CO2) 表示的反应速率为 。
②该反应的平衡常数的表达式为:K=,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③下列各项能作为判断该反应达到平衡的是(填序号字母)。
a.容器内压强保持不变 b.2V(NO)(正)= V(N2)(逆)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
④30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是。
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化率(填“增大”、“不变”或“减小”) 。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |