(10分)在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD,并测得C的浓度为0.4mol/L。由此推断:
xC(g)+2D(g),2min末反应达到平衡状态,生成0.8 molD,并测得C的浓度为0.4mol/L。由此推断:
(1)x值等于 。
(2)B的平衡浓度为 。
(3)A的转化率为 。
(4)生成D的反应速率 。
(5)如果增大反应体系的压强,则平衡体系中C的质量分数 。(填“增大”或“减小”或“不变”)
下表是元素周期表的一部分,请回答有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式 _______________________。
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物对应水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E 。
。
(2)写出A、B两元素最高价氧化物对应水化物相互反应的化学方程式: ________________。
(3)比较C、D的最高价氧化物对应水化物的酸性:(用化学式表示) ____________。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂钯合金作催化剂),它的特点是使CO与NO反应,生成可参与大气生态循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式: _______________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是 _______________________。
(3)控制城市空气污染源的方法可以有 (多选算错)。
| A.开发氢能源 | B.使用电动车 | C.植树造林 | D.戴上呼吸面具 |
用足量的CO还原14 g铁的氧化物的混合物,将生成的气体通入足量的澄清石灰水中,生成沉淀25 g,则这种混合物组成是①FeO、Fe2O3 ②FeO、Fe3O4 ③Fe2O3、Fe3O4中的 ,其物质的量之比为 。
(1)下列反应原理不符合工业冶炼金属实际情况的是( )。
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.Fe3O4+4CO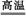 3Fe+4CO2 3Fe+4CO2 |
C.2MgO 2Mg+O2↑ 2Mg+O2↑ |
D.2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
(2)简要说明不符合工业实际的原因: 。