铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平,不考虑2NO2 N2O4)。
N2O4)。
(1)硝酸在该反应中的作用是__________________。
(2)0.004molCu被硝酸完全溶解后,Cu失去的电子数是______________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是______________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为____________;所得溶液(假设溶质不扩散)的物质的量浓度是___________ 。
(3)如果参加反应的Cu和HNO3的物质的量之比是3:10,写出并配平该反应的离子方程式__________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组,其原因是_ 。
己知 : 下列各种物质都由短周期元素组成 , 它们之间的关系如下图所示。
常温下 ,A 、 F 为金属单质 , F 既能与 L 溶液反应, 又能与 N 溶液反应。 C、 H 、 M 为气体单质 , 其中 H 呈黄绿色 ,A 、 B 、 I 、 K 、 L 、 R 的焰色反应均呈黄色。请回答 :
(l)P的结构式为;B 的电子式为___________________;
(2)R水溶液呈碱性的原因可用离子方程式表示为;
(3)还有一种物质能与B反应生成C.写出这个反应的化学方程式_;
(4)还有一种物质能与J反应生成C,写出这个反应的化学方程式_;
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用 ,写出发生的离子反应方程式。
某共价化合物含 C 、 H 、 N三元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和C=C双键。
(1) 试确定该化合物的分子式_____________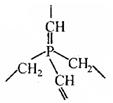
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如上图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: NH4+、Ba2+、 Na+、H+、SO42-、NO3-、OH-、CO32-,将这4种溶液分别标记为A、B、C、D进行如下实验:①在A或D中滴入C,均有沉淀生成;② D和B反应生成的气体能被A吸收;③ A和D反应生成的气体能被B吸收。试回答下列问题 :
(1) D的化学式是, 判断理由
(2) 写出其余几种物质的化学式 : ABC
(3) 写出实验②中有关反应的离子方程式
在一定条件下,RO3n-和I-可以发生反应,离子方程式如下:
RO3n-+6I-+6H+===R-+3I2+3H2O
(1)RO3n-中R元素的化合价为(2)R元素的原子核外最外层电子数为个。
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是。
(2)ZW2的电子式是,它在常温下呈液态,形成晶体时,属于晶体。
(3)工业生产单质Y的原理是(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_______比。